题目内容
【题目】向一定质量AgNO3和Cu(NO3)2的混合溶液中加入一定量的Zn粉,溶液质量随反应时间变化的情况如图所示。下列说法正确的是
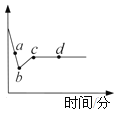
A.取a点溶液,滴加稀盐酸,无白色沉淀
B.c点溶液中溶质为Zn(NO3)2
C.若取b~c段固体,滴加稀盐酸,无气泡产生
D.取d点的固体有2种
【答案】BC
【解析】
试题分析:根据金属活动性顺序可知,Zn>Cu>Ag,故向一定质量的AgNO3和Cu(NO3)2的混合溶液中加入Zn后,Zn与二者均能反应,且Zn与Cu(NO3)2反应生成的Cu,能与AgNO3继续反应生成Ag和Cu(NO3)2,故相当于Zn会先与AgNO3溶液发生反应,置换出最不活泼的Ag,然后才与Cu(NO3)2的溶液反应,置换出较不活泼的Cu。
Zn+2AgNO3=Zn(NO3)2+2Ag
65 216
故析出银的过程是溶液质量减少的过程;
Zn+ Cu(NO3)2=Zn(NO3)2+Cu
65 64
析出铜的过程是溶液质量增加的过程。
A、a点时,由于硝酸银没有完全反应,故溶液中含有剩余的硝酸银,硝酸银和稀盐酸反应会生成氯化银白色沉淀,错误;
B、c点时,硝酸铜恰好完全反应,故溶液中只有生成的硝酸锌,正确;
C、b~c段固体是铜和银,都不能和盐酸反应,正确;
D、d点时,由于锌已过量,故得到的固体有生成的银、铜和剩余的锌,共3种,错误。故选BC

练习册系列答案
相关题目