题目内容
【题目】菱铁矿(主要成分是FeCO3)是炼铁的原料.现取20.0g菱铁矿,向其中加入足量稀硫酸,充分反应,测得固体质量与所加稀硫酸的质量关系如图所示
已知:①FeCO3+H2SO4=FeSO4+CO2↑+H2O ②菱铁矿中杂质不参加反应,且难溶于水.
请计算: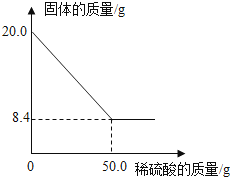
(1)20.0g菱铁矿中FeCO3的质量为 g.
(2)列式计算所用稀硫酸的溶质质量分数(结果准确到0.1%)
【答案】
(1)11.6
(2)
解:设硫酸的质量为x,
FeCO3+H2SO4=FeSO4+CO2↑+H2O,
116 98
11.6g x
![]() ,
,
x=9.8g,
所用稀硫酸的溶质质量分数为:![]() ×100%=19.6%,
×100%=19.6%,
答:所用稀硫酸的溶质质量分数为19.6%.
【解析】(1)20.0g菱铁矿中FeCO3的质量为:20.0g﹣8.4g=11.6g,故填:11.6;
(2)设硫酸的质量为x,
FeCO3+H2SO4=FeSO4+CO2↑+H2O,
116 98
11.6g x![]() ,
,
x=9.8g,
所用稀硫酸的溶质质量分数为:![]() ×100%=19.6%,
×100%=19.6%,
答:所用稀硫酸的溶质质量分数为19.6%.
剩余固体的质量即为杂质的质量,根据杂质的质量可以计算FeCO3的质量;根据FeCO3的质量可以计算反应的硫酸的质量,进一步可以计算所用稀硫酸的溶质质量分数.

练习册系列答案
 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案
相关题目