题目内容
【题目】甲、乙、丙、丁均为初中化学常见物质,都含有地壳中含量最多的元素,且在自然界中可以实现乙和丁的循环。它们之间部分转化关系如下图所示(“→”表示某一种物质经一步反应可转化为另一种物质)。
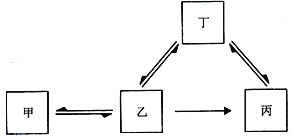
请推断:
(1)若乙是单质,则丙的化学式为________。由甲→乙的化学方程式为_____。
(2)若乙是化合物,则乙→丙反应的化学方程式为_______。
【答案】CO 2H2O通电2H2↑+O2↑ Ca(OH)2+CO2= CaCO3↓+ H2O
【解析】
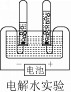
(1)若乙是单质,水在通电的条件下生成氢气和氧气,碳和氧气在点燃的条件下充分燃烧生成二氧化碳,不充分燃烧生成一氧化碳,因此甲是水,乙是氧气,丙是一氧化碳,丁是二氧化碳;则丙的化学式为:CO;甲→乙是水在通电的条件下生成氢气和氧气,反应的化学方程式为:2H2O![]() 2H2↑+O2↑;
2H2↑+O2↑;
(2)若乙是化合物,一氧化碳和氧气在点燃的条件下生成二氧化碳,因此甲是一氧化碳,乙是二氧化碳,丙是碳酸钙,则乙→丙反应的化学方程式为:Ca(OH)2+CO2= CaCO3↓+ H2O。

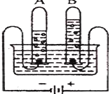
【题目】下表是氯化钠、硝酸钾在不同温度时的溶解度。据此判断:下列说法不正确的是
温度/℃ | 10 | 20 | 30 | 40 | 50 | 60 | |
溶解度/g | 氯化钠 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 |
硝酸钾 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | |
A. 氯化钠和硝酸钾的溶解度曲线在20℃~30℃温度范围内会相交
B. 在20℃时, 向68g饱和氯化钠溶液中加入32g水,此时溶液中溶质的质量分数为18%
C. 从含有少量氯化钠的饱和硝酸钾溶液中得到较多的硝酸钾晶体,可采用冷却热饱和溶液使其结晶的方法
D. 分别将20℃时一定质量的饱和氯化钠溶液、饱和硝酸钾溶液升温至40℃,此时硝酸钾溶液中溶质的质量分数大于氯化钠溶液
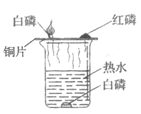
【题目】小明设计了如下图所示的实验装置来证明氧化铜能加快过氧化氢溶液的分解,并与相同条件下![]() 的催化效果做比较,实验时间均以生成
的催化效果做比较,实验时间均以生成![]() 气体为准(即比较反应速率).用图示装置测量产生气体的体积,其它可能影响实验因素均已忽略,相关数据如下:
气体为准(即比较反应速率).用图示装置测量产生气体的体积,其它可能影响实验因素均已忽略,相关数据如下:
实验序号 | 过氧化氢溶液体积 | 催化剂 | 待测数据 |
① |
| 无 | |
② |
| 氧化铜 | |
③ |
|
|
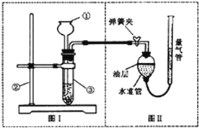
![]() 图中油层的作用是________
图中油层的作用是________
![]() 从设计原理看,实验中的“待测数据”可以是指________.
从设计原理看,实验中的“待测数据”可以是指________.
![]() 为了较准确地测量气体体积,在读取反应前后量气管中液面的读数的过程中,应注意________(填字母编号).
为了较准确地测量气体体积,在读取反应前后量气管中液面的读数的过程中,应注意________(填字母编号).
![]() .视线与凹液面最低处相平
.视线与凹液面最低处相平
![]() .读数前不能移动量气管和水准管
.读数前不能移动量气管和水准管
![]() .保持水准管静止,待水准管中液面不再上升时,立刻读数
.保持水准管静止,待水准管中液面不再上升时,立刻读数
![]() .读数前应上下移动水准管,待两管液面相平再读数
.读数前应上下移动水准管,待两管液面相平再读数
![]() 如果要进一步探究氧化铜是否是该反应的催化剂,请完成下列实验.
如果要进一步探究氧化铜是否是该反应的催化剂,请完成下列实验.
实验步骤和现象 | 设计这一步骤的目的 |
| 氧化铜能够加快过氧化氢溶液的分解 |
________________ | ________________ |
________________ | ________________ |
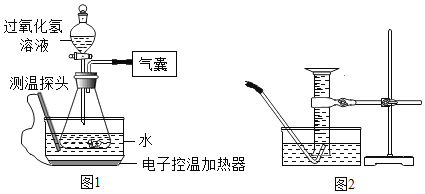
【题目】某小组同学设计并进行实验,探究影响过氧化氢分解速率的因素.(实验装置如图1所示,夹持仪器已略去)
(猜想与假设)影响过氧化氢分解速率的因素可能有温度、溶液的浓度、催化剂种类.
(实验记录)同学们进行6组实验,实验记录如表:
实验序号 | ① | ② | ③ | ④ | ⑤ | ⑥ |
过氧化氢溶液的浓度(%) | 30 | 30 | 15 | 30 | 30 | 30 |
过氧化氢溶液的体积(mL) | 6 | x | 6 | 6 | 6 | 6 |
水槽中水的温度 | 20 | 90 | 70 | 70 | 20 | 20 |
锥形瓶中的物质 | ﹣﹣﹣﹣﹣ | ﹣﹣﹣﹣﹣ | ﹣﹣﹣﹣﹣ | ﹣﹣﹣﹣﹣ | 0.5gNaCl | 0.5gFeCl3 |
60min内产生氧气(mL) | 0.0 | 41.0 | 4.5 | 12.1 | 2.0 | 650.0 |
(解释与结论)
(1)实验②中应加入过氧化氢溶液的体积x是_____mL.
(2)实验①~⑥通过测定相同时间内产生氧气的体积来比较过氧化氢的分解速率,还可以通过测定_____来比较过氧化氢的分解速率.
(3)得出“过氧化氢溶液的浓度越大分解速率越大”结论所依据的实验是_____(填序号).
(4)通过实验①、②、④可得出的结论是_____.
(反思与评价)
(5)同学们认为实验室制氧气,应选择实验⑥而不选实验②的理由是_____(答两点).
(6)某同学改用如图2所示装置代替气囊完成实验②,正确的实验操作顺序是_____.
a.将导管伸入量筒,开启控温加热器,滴入过氧化氢溶液
b.开启控温加热器,将导管伸入量筒,滴入过氧化氢溶液
c.开启控温加热器,滴入过氧化氢溶液,待导管口有连续均匀气泡冒出时将导管伸入量筒.