题目内容
【题目】(9分)金属在工农业生产和日常生活中有着很重要的作用。
(1)不锈钢属于 (填“纯净物”、“混合物”)。
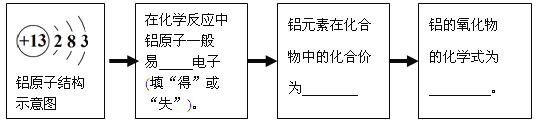
(2)铝制品具有很好的抗腐蚀性能,现在世界上铝的年产量已超过了铜。请将方框内横线上的正确答案填写在答题纸上。
(3)某同学实验结束时,为了回收含有CuSO4、ZnSO4、FeSO4废液中的有关金属和盐,设计了如下实验方案:
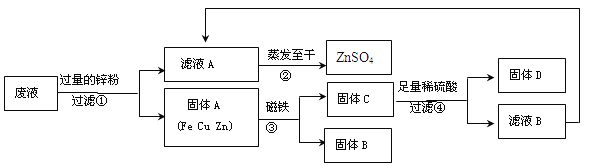
试回答:
Ⅰ.步骤①中锌粉必须过量的原因是 。
Ⅱ.写出步骤①中任一反应的化学方程式 。
Ⅲ.要检验步骤④中加入的稀硫酸是否足量的方法 。
Ⅳ.若实验过程中的物质损失可以忽略,最终所得硫酸锌的质量 (填“>”、“<”或“=”)原废液中硫酸锌的质量。要计算该废液中硫酸铜质量,必须要称量 的质量。
【答案】(1)混合物(2)失 +3 Al2O3(3) Ⅰ.将废液中的Cu2+和Fe2+全部置换出来 Ⅱ.Zn+ CuSO4 = ZnSO4 +Cu (或Fe+CuSO4===Cu+FeSO4、Zn+ FeSO4 = ZnSO4 +Fe) Ⅲ.取步骤④的滤渣于试管中,加入少量稀硫酸,若有气泡产生,则酸不足量(或若无气泡产生,则酸已足量)(其它合理答案也可)Ⅳ. > 固体D(或铜)
【解析】
试题分析:(1) 不锈钢是铁的合金,属于混合物;(2)铝原子最外层电子数为3,在化学反应中易失去电子,从而带三个单位的正电荷,化合价为+3;氧元素化合价为-2,根据“十字交叉法”可知,铝的氧化物为Al2O3;(3)Ⅰ.步骤①中锌粉必须过量的原因是将废液中的铜离子和亚铁离子全部都置换出来;Ⅱ.①中发生的反应有锌和硫酸铜反应,锌和硫酸亚铁反应;Ⅲ.要检验步骤④中加入的稀硫酸是否足量的方法是取步骤④的滤渣于试管中,加入少量稀硫酸,若有气泡产生,则酸不足量(或若无气泡产生,则酸已足量);Ⅳ.最终所得硫酸锌质量等于生成的硫酸锌质量和原废液中硫酸锌质量之和,所以最终得到硫酸锌质量要大于原废液中硫酸锌质量;根据质量守恒定律可知,要计算该废液中硫酸铜质量,必须要称量铜的质量。