题目内容
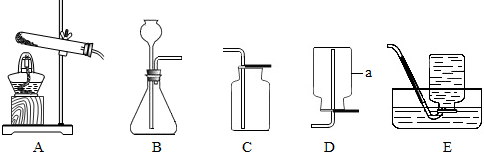
实验室利用下列装置可以制取某些气体,请据图回答问题:
(1)这五个装置示意图中,有一个装置是错误的,指出错误装置是
(2)图示中仪器①的名称是
(3)实验室若用B作发生装置制氧气,则该反应表达式为
(4)硫酸铵的化学式为(NH4)2SO4,求:
①该物质中氮、氢、硫、氧四种元素原子的个数比是
②(NH4)2SO4中各元素的质量比
③264g(NH4)2SO4中含氮元素的质量与多少克尿素[CO(NH2)2]中所含氮元素的质量相等?

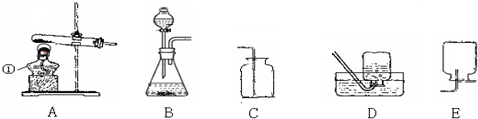
(1)这五个装置示意图中,有一个装置是错误的,指出错误装置是
E
E
(填序号).(2)图示中仪器①的名称是
酒精灯
酒精灯
;实验室用高锰酸钾来制取氧气,可选择A作发生装置,但要对A进行改进,改进的方法是在试管口要放一团棉花
在试管口要放一团棉花
;反应的符号表达式为2KMnO4
K2MnO4+MnO2+O2↑
| ||
2KMnO4
K2MnO4+MnO2+O2↑
该反应前后化合价没发生变化的是
| ||
钾
钾
元素.(3)实验室若用B作发生装置制氧气,则该反应表达式为
2H2O2
2H2O+O2↑
| ||
2H2O2
2H2O+O2↑
.该装置的优点是
| ||
可以控制反应速率
可以控制反应速率
.(4)硫酸铵的化学式为(NH4)2SO4,求:
①该物质中氮、氢、硫、氧四种元素原子的个数比是
2:8:1:4
2:8:1:4
;②(NH4)2SO4中各元素的质量比
7:2:8:16
7:2:8:16
③264g(NH4)2SO4中含氮元素的质量与多少克尿素[CO(NH2)2]中所含氮元素的质量相等?
120g
120g
.分析:(1)用排空气法收集气体时,导管要伸入到集气瓶底部;
(2)熟记常见仪器的名称;实验室用高锰酸钾制取氧气需在试管口要放一团棉花,防止加热时高锰酸钾粉末进入导管;再根据加热高锰酸钾制取氧气的反应原理书写方程式;
(3)根据B装置的特点进行分析,不需要加热,属于“固液常温型”;
(4)根据一个尿素分子的构成、化合物中各元素质量比=各原子的相对原子质量×原子个数之比、物质中某元素的质量=该物质的质量×该元素所占的质量分数和物质中某元素的质量分数=
×100%进行分析.
(2)熟记常见仪器的名称;实验室用高锰酸钾制取氧气需在试管口要放一团棉花,防止加热时高锰酸钾粉末进入导管;再根据加热高锰酸钾制取氧气的反应原理书写方程式;
(3)根据B装置的特点进行分析,不需要加热,属于“固液常温型”;
(4)根据一个尿素分子的构成、化合物中各元素质量比=各原子的相对原子质量×原子个数之比、物质中某元素的质量=该物质的质量×该元素所占的质量分数和物质中某元素的质量分数=
| 元素的相对原子质量×原子个数 |
| 物质的相对分子质量 |
解答:解:(1)E是一个错误装置,用向下排空气法收集氧气时,导管应伸入集气瓶的底部;
(2)①是酒精灯;实验室用高锰酸钾制取氧气需在试管口要放一团棉花,防止加热时高锰酸钾粉末进入导管;高锰酸钾分解生成锰酸钾、二氧化锰、氧气,反应的化学方程式是2KMnO4
K2MnO4+MnO2+O2↑;根据化合物中正负化合价代数和为零可知,该反应前后化合价没发生变化的是钾元素;
(3)B作发生装置制氧气属于固液在常温下反应制取氧气,可选用过氧化氢溶液和二氧化锰制取氧气,过氧化氢在二氧化锰做催化剂的条件下生成水和氧气,方程式是2H2O2
2H2O+O2↑;
该装置的优点是可以控制反应速率;
(4)①根据硫酸铵的化学式可知,在硫酸铵中氮元素、氢元素、硫元素、氧元素的原子个数比为2:8:1:4;
②物质中各元素的质量比等于元素的相对原子质量与原子个数之比,因此硫酸铵中N、H、S、O的质量比为14×2:1×8:32:16×4=28:8:32:64=7:2:8:16;
③由于物质中某元素的质量=物质的质量×该元素所占的质量分数,因此264kg硫酸铵中氮元素的质量为:264kg×21.2%=56kg,
则含有56kg氮元素的尿素的质量为56kg÷(
×100%)=120kg
故答案为:
(1)E;
(2)酒精灯;在试管口要放一团棉花;2KMnO4
K2MnO4+MnO2+O2↑;钾;
(3)2H2O2
2H2O+O2↑;可以控制反应速率;
(4)2:8:1:4;7:2:8:16;120g.
(2)①是酒精灯;实验室用高锰酸钾制取氧气需在试管口要放一团棉花,防止加热时高锰酸钾粉末进入导管;高锰酸钾分解生成锰酸钾、二氧化锰、氧气,反应的化学方程式是2KMnO4
| ||
(3)B作发生装置制氧气属于固液在常温下反应制取氧气,可选用过氧化氢溶液和二氧化锰制取氧气,过氧化氢在二氧化锰做催化剂的条件下生成水和氧气,方程式是2H2O2
| ||
该装置的优点是可以控制反应速率;
(4)①根据硫酸铵的化学式可知,在硫酸铵中氮元素、氢元素、硫元素、氧元素的原子个数比为2:8:1:4;
②物质中各元素的质量比等于元素的相对原子质量与原子个数之比,因此硫酸铵中N、H、S、O的质量比为14×2:1×8:32:16×4=28:8:32:64=7:2:8:16;
③由于物质中某元素的质量=物质的质量×该元素所占的质量分数,因此264kg硫酸铵中氮元素的质量为:264kg×21.2%=56kg,
则含有56kg氮元素的尿素的质量为56kg÷(
| 14×2 |
| 12×1+16×1+(14+1×2)×2 |
故答案为:
(1)E;
(2)酒精灯;在试管口要放一团棉花;2KMnO4
| ||
(3)2H2O2
| ||
(4)2:8:1:4;7:2:8:16;120g.
点评:本考点主要考查发生装置的选取和收集装置的选择,同时也考查了化学方程式的书写,及实验中的一些注意事项,综合性比较强.气体的发生装置的选择与反应物的状态和反应的条件有关;气体的收集装置的选择与气体的密度和溶解性,并分析气体与水和空气中的某些成分是否发生反应.

练习册系列答案
相关题目