题目内容
海水是一种重要的自然资源。以下是我市对海水资源的部分利用。
(1)从海水中获取淡水。常用的操作方法是 。
(2)从海水中获得氯化钠。将海水进行 可得到粗盐;为除去粗盐中含有的SO42-、Ca2+、Mg2+等杂质,有如下操作:①溶解;②加过量的Na2CO3溶液; ③加过量的BaCl2溶液;④加适量的盐酸;⑤加过量NaOH溶液;⑥蒸发结晶;⑦过滤。正确的操作顺序是 。(用序号填一种合理组合)。
(3)从海水中得到金属镁。下图是从海水中提取镁的简单流程。
(1)从海水中获取淡水。常用的操作方法是 。
(2)从海水中获得氯化钠。将海水进行 可得到粗盐;为除去粗盐中含有的SO42-、Ca2+、Mg2+等杂质,有如下操作:①溶解;②加过量的Na2CO3溶液; ③加过量的BaCl2溶液;④加适量的盐酸;⑤加过量NaOH溶液;⑥蒸发结晶;⑦过滤。正确的操作顺序是 。(用序号填一种合理组合)。
(3)从海水中得到金属镁。下图是从海水中提取镁的简单流程。

上述过程中,沉淀B与试剂C发生的是中和反应,则沉淀B的化学式为 ,由无水MgCl2制取Mg的化学方程式为 。海水本身就是含有MgCl2的溶液,它与通过步骤①、②得到的MgCl2溶液有何不同: 。
(4)海水“制碱”。下图是海水“制碱”的部分简单流程。
(4)海水“制碱”。下图是海水“制碱”的部分简单流程。
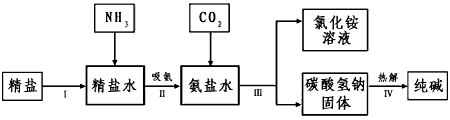
步骤Ⅲ、步骤Ⅳ反应的化学方程式为: 、 。 制氨盐水的过程中要先通入氨气,再通入二氧化碳。如果反过来,二氧化碳的吸收率会降低。这是因为
。
。
(1)蒸馏法
(2)蒸发结晶;①③②⑤⑦④⑥(或①⑤③②⑦④⑥或①③⑤②⑦④⑥)
(3)Mg(OH)2;MgCl2 Mg+Cl2↑;后者是经过富集和分离后的溶液(或海水中含有氯化钠等多种溶质,氯化镁的浓度很低)
Mg+Cl2↑;后者是经过富集和分离后的溶液(或海水中含有氯化钠等多种溶质,氯化镁的浓度很低)
(4)NaCl+NH3+H2O+CO2==NaHCO3+NH4Cl;2NaHCO3 Na2CO3+H2O+CO2↑;氨气溶于水形成碱性溶液,更易于吸收二氧化碳
Na2CO3+H2O+CO2↑;氨气溶于水形成碱性溶液,更易于吸收二氧化碳
(2)蒸发结晶;①③②⑤⑦④⑥(或①⑤③②⑦④⑥或①③⑤②⑦④⑥)
(3)Mg(OH)2;MgCl2
 Mg+Cl2↑;后者是经过富集和分离后的溶液(或海水中含有氯化钠等多种溶质,氯化镁的浓度很低)
Mg+Cl2↑;后者是经过富集和分离后的溶液(或海水中含有氯化钠等多种溶质,氯化镁的浓度很低) (4)NaCl+NH3+H2O+CO2==NaHCO3+NH4Cl;2NaHCO3
 Na2CO3+H2O+CO2↑;氨气溶于水形成碱性溶液,更易于吸收二氧化碳
Na2CO3+H2O+CO2↑;氨气溶于水形成碱性溶液,更易于吸收二氧化碳 
练习册系列答案
相关题目
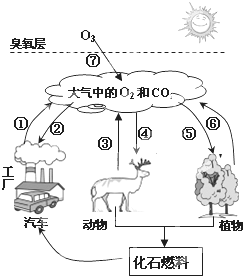 自然界的碳氧循环如图所示是自然界中氧气和二氧化碳的循环简图,请仔细读图回答有关问题:
自然界的碳氧循环如图所示是自然界中氧气和二氧化碳的循环简图,请仔细读图回答有关问题:
 自然界的碳氧循环如图所示是自然界中氧气和二氧化碳的循环简图,请仔细读图回答有关问题:
自然界的碳氧循环如图所示是自然界中氧气和二氧化碳的循环简图,请仔细读图回答有关问题: C6H12O6(葡萄糖)+3O2,生成的葡萄糖供植物生长.则光合作用为植物生长提供的元素有______.
C6H12O6(葡萄糖)+3O2,生成的葡萄糖供植物生长.则光合作用为植物生长提供的元素有______.
 CO2
CO2 二氧化碳+水
二氧化碳+水 Na 2CO3+H2O+CO2↑
Na 2CO3+H2O+CO2↑