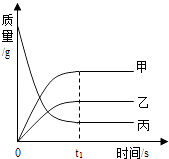
题目内容
【题目】水泥厂是以粘土和石灰石为原料烧制水泥,为检测石灰石中碳酸钙的纯度,在实验室用6.5g样品与10g稀盐酸恰好完全反应,测得残余物的质量为14.3g(杂质不参加反应),求:
(1)生成二氧化碳g
(2)求石灰石中碳酸钙的纯度是多少?(写出计算过程)
【答案】
(1)2.2
(2)
解:设样品中CaCO3的质量为x
CaCO3+2HCl=CaCl2+CO2↑+H2O
100 44
x 2.2g
![]() =
= ![]()
x=5g
碳酸钙的质量分数为: ![]() ×100%=76.9%.
×100%=76.9%.
答:碳酸钙的纯度为76.9%
【解析】解:(1)生成CO2的质量为:16.5g﹣14.3g=2.2g;
【考点精析】本题主要考查了根据化学反应方程式的计算的相关知识点,需要掌握各物质间质量比=系数×相对分子质量之比才能正确解答此题.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
【题目】下面的表格中列出了氢氧化钠在不同温度下的溶解度:
温度(℃) | 20 | 40 | 60 | 80 |
溶解度(g) | 85 | 138 | 203 | 285 |
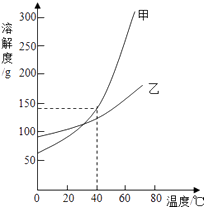
请问:
(1)在如图的甲、乙两条溶解度曲线中,其中表示氢氧化钠溶解度曲线的是 .
(2)在20℃时,向100g水中加100g氢氧化钠,形成氢氧化钠的(填“饱和”或“不饱和“)溶液,将其温度升高至60℃时,溶液的质量为g,该溶液中溶质与溶剂的质量比为 .