题目内容
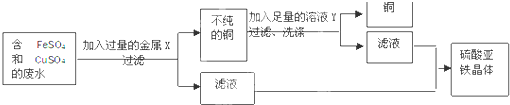
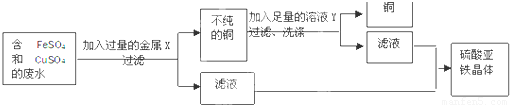
某校化学实验室废液缸中收集了溶解大量FeSO4、CuSO4的废水,设计除去铜离子,回收硫酸亚铁晶体和铜的实验方案,讨论有关问题:
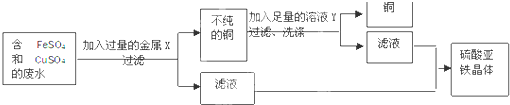
(1)废水在加入金属X前需进行过滤,目的是将其中
(2)金属X是
(3)从滤液中获取硫酸亚铁晶体的操作方法是

(1)废水在加入金属X前需进行过滤,目的是将其中
不溶性杂质.
不溶性杂质.
性杂质除去.进行过滤操作所需的玻璃仪器有:烧杯
烧杯
、玻璃棒
玻璃棒
.(填写两种仪器名称)(2)金属X是
铁
铁
,其加入废水后发生反应的化学方程式为Fe+CuSO4=FeSO4+Cu
Fe+CuSO4=FeSO4+Cu
;溶液Y是稀硫酸
稀硫酸
,利用其除去铜中杂质,有关反应的化学方程式为Fe+H2SO4=FeSO4+H2↑
Fe+H2SO4=FeSO4+H2↑
.(3)从滤液中获取硫酸亚铁晶体的操作方法是
结晶
结晶
.分析:(1)根据过滤的原理及操作过程分析解答;
(2)根据实验方案可知,由于目的是获得铜单质和硫酸亚铁,所以需要将铜离子转化为铜单质,而溶液中需要的是硫酸亚铁而不能引入新的杂质,所以加入的能够将铜离子转化为铜单质的只能是单质铁;由于加入的铁是过量的,加入过量稀硫酸的目的是除去铜中的铁;
(3)从溶液中获取晶体一般都是通过结晶的方法来获取,可以据此解答.
(2)根据实验方案可知,由于目的是获得铜单质和硫酸亚铁,所以需要将铜离子转化为铜单质,而溶液中需要的是硫酸亚铁而不能引入新的杂质,所以加入的能够将铜离子转化为铜单质的只能是单质铁;由于加入的铁是过量的,加入过量稀硫酸的目的是除去铜中的铁;
(3)从溶液中获取晶体一般都是通过结晶的方法来获取,可以据此解答.
解答:解:(1)过滤是将不溶性固体从溶液中分离出来的操作,组装过滤器需要的仪器有:铁架台、漏斗、烧杯和玻璃棒,其中玻璃仪器有:烧杯、漏斗、玻璃棒;
(2)为回收废液中的Cu2+需加入铜前面的金属进行置换,但要得到较为纯净FeSO4的溶液,只能向废液中加入过量的铁粉与硫酸铜发生置换反应,生成物中只有硫酸亚铁,加入其它金属溶液中又混有其它溶质.所以金属X是铁粉,反应的方程式是:Fe+CuSO4=FeSO4+Cu;铜排在氢后面,不与酸反应,而铁排在氢前面,与酸反应,因此为除去混在铜粉里的铁粉并且得到FeSO4溶液,把金属混合物放入足量的稀硫酸并过滤即可,所以,溶液Y是稀硫酸,反应的方程式是:Fe+H2SO4=FeSO4+H2↑;
(3)要从滤液中获取硫酸亚铁晶体,需要采取蒸发结晶或降温结晶,使硫酸亚铁从溶液中结晶析出.
故答案为:(1)不溶性杂质,烧杯、玻璃棒;(2)铁,Fe+CuSO4=FeSO4+Cu;稀硫酸,Fe+H2SO4=FeSO4+H2↑;(3)结晶.
(2)为回收废液中的Cu2+需加入铜前面的金属进行置换,但要得到较为纯净FeSO4的溶液,只能向废液中加入过量的铁粉与硫酸铜发生置换反应,生成物中只有硫酸亚铁,加入其它金属溶液中又混有其它溶质.所以金属X是铁粉,反应的方程式是:Fe+CuSO4=FeSO4+Cu;铜排在氢后面,不与酸反应,而铁排在氢前面,与酸反应,因此为除去混在铜粉里的铁粉并且得到FeSO4溶液,把金属混合物放入足量的稀硫酸并过滤即可,所以,溶液Y是稀硫酸,反应的方程式是:Fe+H2SO4=FeSO4+H2↑;
(3)要从滤液中获取硫酸亚铁晶体,需要采取蒸发结晶或降温结晶,使硫酸亚铁从溶液中结晶析出.
故答案为:(1)不溶性杂质,烧杯、玻璃棒;(2)铁,Fe+CuSO4=FeSO4+Cu;稀硫酸,Fe+H2SO4=FeSO4+H2↑;(3)结晶.
点评:金属活动顺序表是解决与金属相关变化的重要工具,表中H元素为标志性参考元素,H之前为活泼金属,H之后金属性质不活泼.

练习册系列答案
 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案
相关题目