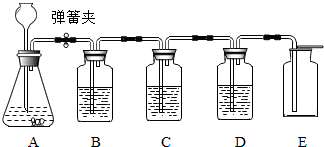
题目内容
过氧化氢(H2O2)溶液在MnO2做催化剂的条件下,能迅速分解生成O2和H2O.分液漏斗可以通过调节活塞控制液体的滴加速度.现欲制取干燥而纯净的氧气,可采用图1装置:回答下列问题:
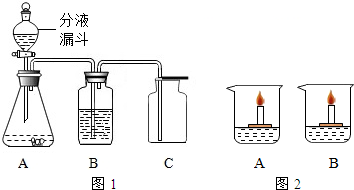
(1)分液漏斗中盛放的物质是 ;
(2)装置B中的药品是 ;
(3)用该实验代替加热KMnO4制取O2,优点是 (填序号)
①生成物只有氧气 ②不需加热 ③生成氧气多
(4)如果要确认C中气体已经干燥,则需在B和C之间连接一个U型管,U型管中应放的物质为 .
(5)若改变装置A中的药品,此套装置还可以用来制取 气体.
(6)两个同学在开展研究性学习时,做了一个十分有趣的实验,装置如图2所示.在烧杯A、B中分别盛两种溶质不同的无色溶液,小木块上各有一支点燃的蜡烛,向A烧杯撒入无色细小晶体后,发现烧杯中蜡烛会熄灭,向B烧杯中撒入黑色粉末后,则发现烧杯中蜡烛燃烧更旺.
①烧杯A中蜡烛熄灭的原因是 ,撒入的无色晶体可能是 .
②烧杯B中蜡烛燃烧更旺的原因是 .写出该反应的方程式 .

(1)分液漏斗中盛放的物质是
(2)装置B中的药品是
(3)用该实验代替加热KMnO4制取O2,优点是
①生成物只有氧气 ②不需加热 ③生成氧气多
(4)如果要确认C中气体已经干燥,则需在B和C之间连接一个U型管,U型管中应放的物质为
(5)若改变装置A中的药品,此套装置还可以用来制取
(6)两个同学在开展研究性学习时,做了一个十分有趣的实验,装置如图2所示.在烧杯A、B中分别盛两种溶质不同的无色溶液,小木块上各有一支点燃的蜡烛,向A烧杯撒入无色细小晶体后,发现烧杯中蜡烛会熄灭,向B烧杯中撒入黑色粉末后,则发现烧杯中蜡烛燃烧更旺.
①烧杯A中蜡烛熄灭的原因是
②烧杯B中蜡烛燃烧更旺的原因是
考点:氧气的制取装置,气体的干燥(除水),氧气的化学性质,氧气的收集方法,反应现象和本质的联系,书写化学方程式、文字表达式、电离方程式,灭火的原理和方法
专题:常见气体的实验室制法、检验、干燥与净化
分析:(1)根据分液漏斗的作用来分析;
(2)根据浓硫酸的性质来分析;
(3)根据两种制取氧气的方法的区别来分析;
(4)利用无水硫酸铜遇水变蓝色来分析;
(5)根据实验装置来分析所能制取的气体;
(6)①无色溶液为稀盐酸,向A烧杯撒入无色细小晶体后,发现烧杯中蜡烛会熄灭,推测二者生成的为具有灭火作用的二氧化碳;②无色溶液为双氧水,向B烧杯中撒入黑色粉末后,则发现烧杯中蜡烛燃烧更旺,推测二者生成的物质为具有助燃性的氧气.
(2)根据浓硫酸的性质来分析;
(3)根据两种制取氧气的方法的区别来分析;
(4)利用无水硫酸铜遇水变蓝色来分析;
(5)根据实验装置来分析所能制取的气体;
(6)①无色溶液为稀盐酸,向A烧杯撒入无色细小晶体后,发现烧杯中蜡烛会熄灭,推测二者生成的为具有灭火作用的二氧化碳;②无色溶液为双氧水,向B烧杯中撒入黑色粉末后,则发现烧杯中蜡烛燃烧更旺,推测二者生成的物质为具有助燃性的氧气.
解答:解:(1)分液漏斗中盛放的是液体药品,也就是过氧化氢溶液;
(2)浓硫酸具有吸水性,可以将氧气进行干燥;
(3)用高锰酸钾制取氧气需要加热,而用过氧化氢溶液制取氧气是在常温下进行的;
(4)因为白色的无水硫酸铜遇到水会变成蓝色,所以可以用无水硫酸铜来检验;
(5)该装置是利用固液常温下来制取气体的,所以还可以用来制取二氧化碳;
(6)在烧杯A、B中分别盛两种溶质不同的无色溶液,小木块上各有一支点燃的蜡烛,向A烧杯撒入无色细小晶体后,发现烧杯中蜡烛会熄灭,向B烧杯中撒入黑色粉末后,则发现烧杯中蜡烛燃烧更旺.
则可推测:①烧杯A中蜡烛熄灭的原因是:碳酸钠与稀盐酸反应生成二氧化碳,二氧化碳不可燃不支持燃烧所以蜡烛熄灭,撒入的无色晶体可能是:碳酸钠晶体.
②烧杯B中蜡烛燃烧更旺的原因是:过氧化氢溶液在二氧化锰催化作用下生成氧气,氧气能支持燃烧,所以蜡烛燃烧更旺.写出该反应的方程式:2H2O2
2H2O+O2↑.
故答案为:(1)过氧化氢溶液(或双氧水、H2O2);(2)浓硫酸;(3)②;
(4)无水硫酸铜(或硫酸铜、CuSO4); (5)二氧化碳(或CO2);
(6)①碳酸钠与稀盐酸反应生成二氧化碳,二氧化碳不可燃不支持燃烧所以蜡烛熄灭;碳酸钠晶体;②过氧化氢溶液在二氧化锰催化作用下生成氧气,氧气能支持燃烧,所以蜡烛燃烧更旺;2H2O2
2H2O+O2↑.
(2)浓硫酸具有吸水性,可以将氧气进行干燥;
(3)用高锰酸钾制取氧气需要加热,而用过氧化氢溶液制取氧气是在常温下进行的;
(4)因为白色的无水硫酸铜遇到水会变成蓝色,所以可以用无水硫酸铜来检验;
(5)该装置是利用固液常温下来制取气体的,所以还可以用来制取二氧化碳;
(6)在烧杯A、B中分别盛两种溶质不同的无色溶液,小木块上各有一支点燃的蜡烛,向A烧杯撒入无色细小晶体后,发现烧杯中蜡烛会熄灭,向B烧杯中撒入黑色粉末后,则发现烧杯中蜡烛燃烧更旺.
则可推测:①烧杯A中蜡烛熄灭的原因是:碳酸钠与稀盐酸反应生成二氧化碳,二氧化碳不可燃不支持燃烧所以蜡烛熄灭,撒入的无色晶体可能是:碳酸钠晶体.
②烧杯B中蜡烛燃烧更旺的原因是:过氧化氢溶液在二氧化锰催化作用下生成氧气,氧气能支持燃烧,所以蜡烛燃烧更旺.写出该反应的方程式:2H2O2
| ||
故答案为:(1)过氧化氢溶液(或双氧水、H2O2);(2)浓硫酸;(3)②;
(4)无水硫酸铜(或硫酸铜、CuSO4); (5)二氧化碳(或CO2);
(6)①碳酸钠与稀盐酸反应生成二氧化碳,二氧化碳不可燃不支持燃烧所以蜡烛熄灭;碳酸钠晶体;②过氧化氢溶液在二氧化锰催化作用下生成氧气,氧气能支持燃烧,所以蜡烛燃烧更旺;2H2O2
| ||
点评:熟记利用双氧水制取氧气和制取二氧化碳的装置;了解气体的干燥方法;了解物质燃烧的必须条件.正确熟记有关化学方程式.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
最近科学家制得一种新的分子,它是由碳元素组成的,具有空心的类似足球结构的一种分子,化学式是C60,下列说法中不正确的( )
| A、C60是一种新型的化合物 |
| B、C60和石墨是不同的碳单质 |
| C、C60是一种新的碳单质 |
| D、C60相对分子质量是720 |
已知某可燃物燃烧时只生成二氧化碳和水,由此可推断出( )
| A、该物质中可能含有碳、氢两种元素 |
| B、该物质中一定含有碳、氢两种元素,可能含有氧元素 |
| C、只含有碳元素,可能含有氢元素 |
| D、只含有氧元素,可能含有碳、氢两种元素 |