题目内容
(2013?天桥区三模)如图所示为实验室中常见的气体的制备、干燥、净化、收集和性质实验的部分仪器,试根据题目要求
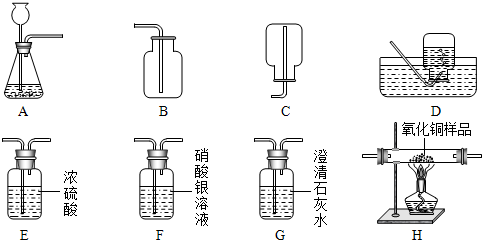
回答下列问题:
(1)用CaCO3固体和稀盐酸反应制取并收集干燥、纯净的二氧化碳.
①所选仪器的连接顺序为
②生成二氧化碳时所发生反应的化学方程式为
(2)小瑜同学欲用锌和稀硫酸反应制取氢气并用干燥的氢气测定某不纯氧化铜样品的纯度(杂质为单质铜),小瑜同学设计了实验方案,选择的装置按A→E1→H→E2→E3顺序连接,然后进行实验(H中发生反应的化学方程式为CuO+H2△Cu+H2O;E1、E2、E3为3个盛有浓硫酸的洗气瓶,假设试剂对气体的吸收均完全).
①装置A中发生反应的化学方程式为
②装置E1的作用是
③给氧化铜样品加热前,小瑜同学先向盛氧化铜样品的玻璃管中通入了一段时间的氢气.你认为他的操作是否正确,并说明理由
④小瑜通过测量反应前后E2装置的质量变化,来计算氧化铜样品的纯度.除此方法,你认为还可以通过测量来计算氧化铜样品纯度的方法是

回答下列问题:
(1)用CaCO3固体和稀盐酸反应制取并收集干燥、纯净的二氧化碳.
①所选仪器的连接顺序为
AFEB
AFEB
(填写仪器序号字母).②生成二氧化碳时所发生反应的化学方程式为
CaCO3+2HCl=CaCl2+H2O+CO2↑
CaCO3+2HCl=CaCl2+H2O+CO2↑
.(2)小瑜同学欲用锌和稀硫酸反应制取氢气并用干燥的氢气测定某不纯氧化铜样品的纯度(杂质为单质铜),小瑜同学设计了实验方案,选择的装置按A→E1→H→E2→E3顺序连接,然后进行实验(H中发生反应的化学方程式为CuO+H2△Cu+H2O;E1、E2、E3为3个盛有浓硫酸的洗气瓶,假设试剂对气体的吸收均完全).
①装置A中发生反应的化学方程式为
Zn+H2SO4=ZnSO4+H2↑
Zn+H2SO4=ZnSO4+H2↑
.②装置E1的作用是
吸水干燥氢气
吸水干燥氢气
.③给氧化铜样品加热前,小瑜同学先向盛氧化铜样品的玻璃管中通入了一段时间的氢气.你认为他的操作是否正确,并说明理由
正确,先通入氢气,赶走装置中的空气,避免发生爆炸
正确,先通入氢气,赶走装置中的空气,避免发生爆炸
.④小瑜通过测量反应前后E2装置的质量变化,来计算氧化铜样品的纯度.除此方法,你认为还可以通过测量来计算氧化铜样品纯度的方法是
称量氧化铜样品反应前后的质量,通过差值计算纯度
称量氧化铜样品反应前后的质量,通过差值计算纯度
.反应一段时间后先停止对玻璃管的加热并持续通入氢气至玻璃管冷却后,将被测样品取出,发现红色固体中存在少量黑色固体,则小瑜测得的氧化铜样品纯度与实际值比较将偏小
偏小
(填“偏大”、“偏小”、“基本一致”之一).分析:制取装置包括加热和不需加热两种,实验室制取CO2,是在常温下,用碳酸钙和盐酸互相交换成分生成氯化钙和水和二氧化碳,因此不需要加热.二氧化碳能溶于水,密度比空气的密度大,因此只能用向上排空气法收集;要收集干燥、纯净的二氧化碳,必须先用硝酸银溶液除去少量的氯化氢气体,再用浓硫酸干燥,最后用向上排空气法收集.实验室是用锌粒和稀硫酸在常温下反应制氢气的,氢气难溶于水,密度比空气的密度小,因此可以用排水法和向下排空气法收集.装置E1的作用是,得到干燥的氢气的;小瑜同学先向盛氧化铜样品的玻璃管中通入了一段时间的氢气,是正确的步骤,目的是:先通入氢气,赶走装置中的空气,避免发生爆炸;来计算氧化铜样品纯度的方法还有:称量氧化铜样品反应前后的质量,通过差值计算纯度;反应一段时间后先停止对玻璃管的加热并持续通入氢气至玻璃管冷却后,将被测样品取出,发现红色固体中存在少量黑色固体,则小瑜测得的氧化铜样品纯度与实际值比较将偏小,因为还有一部分氧化铜没有反应.
解答:解:(1)实验室制取CO2,是在常温下,用碳酸钙和盐酸互相交换成分生成氯化钙和水和二氧化碳,因此不需要加热.二氧化碳能溶于水,密度比空气的密度大,因此只能用向上排空气法收集;要收集干燥、纯净的二氧化碳,必须先用硝酸银溶液除去少量的氯化氢气体,再用浓硫酸干燥,最后用向上排空气法收集,故答案为:①AFEB;②CaCO3+2HCl=CaCl2+H2O+CO2↑
(2)实验室是用锌粒和稀硫酸在常温下反应制氢气的,锌和硫酸反应生成硫酸锌和氢气,①故答案为:Zn+H2SO4=ZnSO4+H2↑;
②装置E1的作用是,得到干燥的氢气的,故答案为:吸水干燥氢气;
③小瑜同学先向盛氧化铜样品的玻璃管中通入了一段时间的氢气,是正确的步骤,目的是:先通入氢气,赶走装置中的空气,避免发生爆炸,故答案为:正确,先通入氢气,赶走装置中的空气,避免发生爆炸;
④来计算氧化铜样品纯度的方法还有:称量氧化铜样品反应前后的质量,通过差值计算纯度;反应一段时间后先停止对玻璃管的加热并持续通入氢气至玻璃管冷却后,将被测样品取出,发现红色固体中存在少量黑色固体,则小瑜测得的氧化铜样品纯度与实际值比较将偏小,因为还有一部分氧化铜没有反应;故答案为:称量氧化铜样品反应前后的质量,通过差值计算纯度;偏小;
(2)实验室是用锌粒和稀硫酸在常温下反应制氢气的,锌和硫酸反应生成硫酸锌和氢气,①故答案为:Zn+H2SO4=ZnSO4+H2↑;
②装置E1的作用是,得到干燥的氢气的,故答案为:吸水干燥氢气;
③小瑜同学先向盛氧化铜样品的玻璃管中通入了一段时间的氢气,是正确的步骤,目的是:先通入氢气,赶走装置中的空气,避免发生爆炸,故答案为:正确,先通入氢气,赶走装置中的空气,避免发生爆炸;
④来计算氧化铜样品纯度的方法还有:称量氧化铜样品反应前后的质量,通过差值计算纯度;反应一段时间后先停止对玻璃管的加热并持续通入氢气至玻璃管冷却后,将被测样品取出,发现红色固体中存在少量黑色固体,则小瑜测得的氧化铜样品纯度与实际值比较将偏小,因为还有一部分氧化铜没有反应;故答案为:称量氧化铜样品反应前后的质量,通过差值计算纯度;偏小;
点评:本考点主要考查了装置的连接、气体的制取装置和收集装置的选择,同时也考查了化学方程式的书写等,综合性比较强.气体的制取装置的选择与反应物的状态和反应的条件有关;气体的收集装置的选择与气体的密度和溶解性有关.本考点是中考的重要考点之一,主要出现在实验题中.

练习册系列答案
相关题目
 (2013?天桥区三模)溶液对动植物的生理活动和人类的生产、科研活动具有很重要的意义.
(2013?天桥区三模)溶液对动植物的生理活动和人类的生产、科研活动具有很重要的意义.
