题目内容
(2011?南京一模)某中学同学学完第十一单元后,在教师的指导下对“酸、碱、盐之间并不是都能发生复分解反应,发生复分解反应应具备哪些条件?”设计了如下科学探究活动.(1)提出问题:发生复分解反应应具备哪些条件?
(2)猜想与假设:①酸、碱、盐的溶液混和后溶液中自由移动的离子变少了,反应就发生了;②酸、碱、盐的溶液混和后,肉眼能看到新物质的产生(例如,有沉淀或气体),反应才发生.
(3)进行实验并观察实验现象,请结合实验完成下表:
| 实验步骤 | 实验现象 | 化学反应方程式 |
| ①硝酸钡溶液中滴加稀硫酸 | ______ | H2SO4+Ba(NO3)2=BaSO4↓+2HNO3 |
| ②稀硫酸溶液中滴加碳酸钾溶液 | ______ | H2SO4+K2CO3=K2SO4+CO2↑+H2O |
| ③稀盐酸溶液中先加2滴酚酞试液再滴加氢氧化钠溶液 | 溶液由无色变浅红色,并不褪色 | ______ |
| ④硝酸钡溶液中滴加碳酸钾溶液 | 有白色沉淀 | ______ |
| ⑤氯化铵溶液中滴加浓氢氧化钠溶液后加热,并用湿的红石蕊试纸检验生成的气体 | 有无色、刺激性气味的气体生成,该气体能使湿的红石蕊试纸变蓝 | ______ |
【答案】分析:(3)根据现象与结论间的关系,由现象归纳结论或由结论反推现象;
(4)对反应中的离子间反应关系进行归纳,判断猜想的正误;
(5)根据反应中的离子关系,对所探究的知识进行网络化梳理,完成知识网络中所空缺部分;
(6)根据所给物质的溶解性,利用复分解反应发生的条件,判断四种物质间所能发生的复分解反应,写出反应的化学方程式.
解答:解:(3)①硝酸钡溶液中滴加稀硫酸,硝酸钡与硫酸反应生成硫酸钡的白色沉淀;
②稀硫酸溶液中滴加碳酸钾溶液,硫酸与碳酸钾反应放出气体二氧化碳,因此观察到有气泡;
③稀盐酸溶液中滴加氢氧化钠溶液,氢氧化钠与盐酸反应生成氯化钠和水,HCl+NaOH=NaCl+H2O;
④硝酸钡溶液中滴加碳酸钾溶液,碳酸钾与硝酸钡反应生成碳酸钡沉淀和硝酸钾,Ba(NO3)2+K2 CO3=Ba CO3↓+2 KNO3;
⑤氯化铵溶液中滴加浓氢氧化钠溶液后加热,氢氧化钠与氯化铵反应放出氨气同时生成水和氯化钠,NH4Cl+NaOH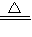 NaCl+NH3↑+H2O;
NaCl+NH3↑+H2O;
(4))④中钡离子与碳酸根离子能形成碳酸钡沉淀,Ba2++CO32-→BaCO3↓;⑤中的铵根离子与氢氧根离子形成水和氨气,NH4++OH-→NH3↑+H2O;酸、碱、盐的溶液混和后,溶液中存在的离子若能形成气体、沉淀或水这些难电离的物质时,溶液中自由移动的离子变少了,反应就发生了,因此猜想①是正确的;
(5)离子关系网络中,OH-能与NH4+形成气体氨气和水,H+能与HCO3-形成气体二氧化碳和水,CO32-能与Ca2+形成碳酸钙沉淀;
(6)由于在溶剂B中,氯化钡的溶解度几乎为0,小于氯化银的溶解度,可以说在该溶剂中氯化钡是沉淀而氯化银能溶,因此在溶剂B中因生成氯化钡沉淀而发生复分解反应的化学方程式为2AgCl+Ba(NO3)2=BaCl2↓+2AgNO3;
故答案为:
(3)①有白色沉淀(或出现白色沉淀,或产生白色沉淀,或有白色沉淀生成);
②冒气泡(或产生气泡,或出现气泡,写生成气体不给分);
③HCl+NaOH=NaCl+H2O;
④Ba(NO3)2+K2 CO3=Ba CO3↓+2 KNO3;
⑤NH4Cl+NaOH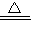 NaCl+NH3↑+H2O;
NaCl+NH3↑+H2O;
(4)④Ba2++CO32-→BaCO3↓;⑤NH4++OH-→NH3↑+H2O;①;
(5)①NH4+;②HCO3-;③Ca2+;
(6)2AgCl+Ba(NO3)2=BaCl2↓+2AgNO3.
点评:酸、碱、盐溶液间发生的反应,其实质是溶液中离子形成难电离物质气体、水或沉淀的过程.
(4)对反应中的离子间反应关系进行归纳,判断猜想的正误;
(5)根据反应中的离子关系,对所探究的知识进行网络化梳理,完成知识网络中所空缺部分;
(6)根据所给物质的溶解性,利用复分解反应发生的条件,判断四种物质间所能发生的复分解反应,写出反应的化学方程式.
解答:解:(3)①硝酸钡溶液中滴加稀硫酸,硝酸钡与硫酸反应生成硫酸钡的白色沉淀;
②稀硫酸溶液中滴加碳酸钾溶液,硫酸与碳酸钾反应放出气体二氧化碳,因此观察到有气泡;
③稀盐酸溶液中滴加氢氧化钠溶液,氢氧化钠与盐酸反应生成氯化钠和水,HCl+NaOH=NaCl+H2O;
④硝酸钡溶液中滴加碳酸钾溶液,碳酸钾与硝酸钡反应生成碳酸钡沉淀和硝酸钾,Ba(NO3)2+K2 CO3=Ba CO3↓+2 KNO3;
⑤氯化铵溶液中滴加浓氢氧化钠溶液后加热,氢氧化钠与氯化铵反应放出氨气同时生成水和氯化钠,NH4Cl+NaOH
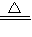 NaCl+NH3↑+H2O;
NaCl+NH3↑+H2O;(4))④中钡离子与碳酸根离子能形成碳酸钡沉淀,Ba2++CO32-→BaCO3↓;⑤中的铵根离子与氢氧根离子形成水和氨气,NH4++OH-→NH3↑+H2O;酸、碱、盐的溶液混和后,溶液中存在的离子若能形成气体、沉淀或水这些难电离的物质时,溶液中自由移动的离子变少了,反应就发生了,因此猜想①是正确的;
(5)离子关系网络中,OH-能与NH4+形成气体氨气和水,H+能与HCO3-形成气体二氧化碳和水,CO32-能与Ca2+形成碳酸钙沉淀;
(6)由于在溶剂B中,氯化钡的溶解度几乎为0,小于氯化银的溶解度,可以说在该溶剂中氯化钡是沉淀而氯化银能溶,因此在溶剂B中因生成氯化钡沉淀而发生复分解反应的化学方程式为2AgCl+Ba(NO3)2=BaCl2↓+2AgNO3;
故答案为:
(3)①有白色沉淀(或出现白色沉淀,或产生白色沉淀,或有白色沉淀生成);
②冒气泡(或产生气泡,或出现气泡,写生成气体不给分);
③HCl+NaOH=NaCl+H2O;
④Ba(NO3)2+K2 CO3=Ba CO3↓+2 KNO3;
⑤NH4Cl+NaOH
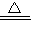 NaCl+NH3↑+H2O;
NaCl+NH3↑+H2O;(4)④Ba2++CO32-→BaCO3↓;⑤NH4++OH-→NH3↑+H2O;①;
(5)①NH4+;②HCO3-;③Ca2+;
(6)2AgCl+Ba(NO3)2=BaCl2↓+2AgNO3.
点评:酸、碱、盐溶液间发生的反应,其实质是溶液中离子形成难电离物质气体、水或沉淀的过程.

练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案
相关题目
