题目内容
(2008?吉林)钢铁厂购进含氧化铁(Fe2O3)85%的赤铁矿1000t.准备用这些铁矿石炼取含杂质3%的生铁.(1)如图所示.请将求算纯铁质量的计算过程填写完整.

(2)请利用化学方程式计算生铁的质量.(反应原理为3CO+Fe2O3
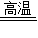 Fe+3CO2)(计算结果保留整数)
Fe+3CO2)(计算结果保留整数)
【答案】分析:(1)此题是利用铁元素在化学反应前后质量不变的原理解决,先用矿石乘以含氧化铁的质量分数求出氧化铁的质量,再利用化学式的计算出含有的铁元素的质量即是纯铁的质量.
(2)同理计算出氧化铁的质量利用这一反应物可求生成物纯铁的质量,再利用其除以3%可求出生铁的质量.
解答:解:(1)矿石中氧化铁的质量是:1000t×85%=850t,纯铁的质量是:1000t×85%×(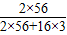 ×100%)
×100%)
故答案为:850t;1000t×85%×(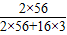 ×100%)
×100%)
(2)由题意得,1000t赤铁矿中含氧化铁的质量是:
1000t×85%=850t
设生成纯铁的质量为X
3CO+Fe2O3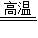 2Fe+3CO2
2Fe+3CO2
160 112
850t X
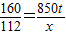
X=595t
生铁的质量是:595t÷(1-3%)=613t
答:生铁的质量为613t.
点评:此题是同一问题的两种不同解决方式,一是利用化学式计算含杂质物质的某种元素的质量,二是利用化学方程式的计算,形式不同但结果相同,开阔了学生的视野.
(2)同理计算出氧化铁的质量利用这一反应物可求生成物纯铁的质量,再利用其除以3%可求出生铁的质量.
解答:解:(1)矿石中氧化铁的质量是:1000t×85%=850t,纯铁的质量是:1000t×85%×(
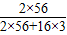 ×100%)
×100%)故答案为:850t;1000t×85%×(
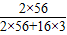 ×100%)
×100%)(2)由题意得,1000t赤铁矿中含氧化铁的质量是:
1000t×85%=850t
设生成纯铁的质量为X
3CO+Fe2O3
 2Fe+3CO2
2Fe+3CO2160 112
850t X
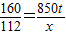
X=595t
生铁的质量是:595t÷(1-3%)=613t
答:生铁的质量为613t.
点评:此题是同一问题的两种不同解决方式,一是利用化学式计算含杂质物质的某种元素的质量,二是利用化学方程式的计算,形式不同但结果相同,开阔了学生的视野.

练习册系列答案
 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案
相关题目

