题目内容
【题目】有A、B、C三种元素,在空气中A的单质约占总体积的21%,B元素能与A元素组成相对分子质量最小的氧化物D,D在常温常压下为无色无味的液体。C元素的单质能在A元素的单质中燃烧,发出蓝紫色火焰,生成刺激性气味的气体E。回答下列问题:
(1)A单质的化学式为________________;
(2)B元素的名称为____________________;
(3)D的化学式为______________;
(4)E中C元素的化合价表示为________________。
【答案】![]() 氢
氢 ![]()
![]()
【解析】
在空气中A的单质约占总体积的21%,故A是氧元素;相对分子质量最小的氧化物是水,B元素能与A元素组成相对分子质量最小的氧化物D,故B是氢元素,D是水;C元素的单质能在A元素的单质中燃烧,发出蓝紫色火焰,这是硫在氧气燃烧的现象,故C是硫元素,生成的D是二氧化硫;代入验证,猜想成立。
(1)A单质是氧气,化学式为![]() ;
;
(2)B元素的名称为氢;
(3)D是水,化学式为![]() ;
;
(4)E是二氧化硫,二氧化硫中,氧元素显-2价,根据化合物中各元素化合价的代数和为零,可知硫元素显+4价,C元素的化合价表示为![]() 。
。

【题目】二氧化锰是不是过氧化氢溶液分解的唯一催化剂?对此小明设计了如下探究方案。
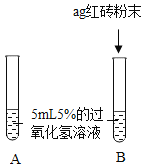
(提出问题)红砖粉末能否作为过氧化氢溶液分解的催化剂?如果能,效果如何?
(实验探究)
实验步骤 | 实验现象 | 实验结论及解释` |
I.
| A中无明显现象,B中产生大量能使带火星木条复燃的气体。 | ①产生的气体是_________。 ②红砖粉末能改变过氧化氢分解速率。 |
Ⅱ.向B试管中重新加入5%的过氧化氢溶液;反应停止后过滤、洗涤、干燥、称量滤渣。 | B又产生大量能使带火星木条复燃的气体;滤渣质量等于ag。 | 红砖粉末的_______、_______在反应前后均没有发生变化,能作过氧化氢分解的催化剂。 |
III.
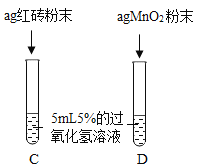
| 两试管中均产生气泡且_______ 。 | 红砖粉末的催化效果没有二氧化锰粉末好。 |
请写出红砖粉末(成分以Fe2O3表示)催化过氧化氢溶液分解反应的化学方程式_______。
(反思)(1)小明在实验时发现试管内有许多水雾,由此推断过氧化氢分解是_______(填“放热”或“吸热”)反应。
(2)实验过程中发现将过氧化氢溶液加入红砖粉末的试管后,反应速率是逐渐加快,然后又逐渐变慢。从影响反应速率的因素来分析过氧化氢分解速率变化的原因________。