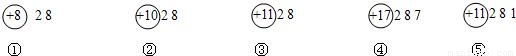题目内容
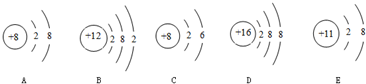
14、如图是几中粒子的结构示意图,请回答下列问题:
(1)以上结构示意图表示了
(2)带电的粒子的序号是
(3)氟原子的化学性质与上述

(1)以上结构示意图表示了
4
种元素.(2)带电的粒子的序号是
①③
,它们形成的化合物的化学式是
Na2O
.(3)氟原子的化学性质与上述
④
(填序号)的相似.分析:(1)根据元素是具有相同核电荷数(即核内质子数)的一类原子的总称,不同种元素之间的本质区别是质子数不同,进行解答;
(2)根据当核电荷数=质子数>核外电子数,为阳离子;当核电荷数=质子数<核外电子数,为阴离子;进行解答;
(3)根据元素周期律:同族元素,最外层电子数相同的元素化学性质相似,进行解答.
(2)根据当核电荷数=质子数>核外电子数,为阳离子;当核电荷数=质子数<核外电子数,为阴离子;进行解答;
(3)根据元素周期律:同族元素,最外层电子数相同的元素化学性质相似,进行解答.
解答:解:(1)根据元素是具有相同核电荷数(即核内质子数)的一类原子的总称,不同种元素之间的本质区别是质子数不同,由此可知:图中有四种不同的质子数,即有4种元素;故答案为:4;
(2)根据当核电荷数=质子数>核外电子数,为阳离子;当核电荷数=质子数<核外电子数,为阴离子;由此可知:①为阴离子O2-,③为阳离子Na+,形成的化合物的化学式为:Na2O;故答案为:①③;Na2O;
(3)根据元素周期律:同族元素,最外层电子数相同,元素化学性质相似,氟原子的最外层电子数为7,与④的最外层电子数相同,化学性质相似;故答案为:④.
(2)根据当核电荷数=质子数>核外电子数,为阳离子;当核电荷数=质子数<核外电子数,为阴离子;由此可知:①为阴离子O2-,③为阳离子Na+,形成的化合物的化学式为:Na2O;故答案为:①③;Na2O;
(3)根据元素周期律:同族元素,最外层电子数相同,元素化学性质相似,氟原子的最外层电子数为7,与④的最外层电子数相同,化学性质相似;故答案为:④.
点评:本题考查学生对元素的概念和根据核电荷数,质子数与核外电子数的关系辨别带电粒子及同族元素,最外层电子数相同,元素化学性质相似知识理解与掌握,并能灵活应用于解题.

练习册系列答案
 全能测控一本好卷系列答案
全能测控一本好卷系列答案 发散思维新课堂系列答案
发散思维新课堂系列答案
相关题目