题目内容
30g锌可以跟150g硫酸溶液恰好反应,计算:
(1)可制得氢气多少克?
(2)这种硫酸溶液中溶质的质量分数是多少?
解:设30g锌完全反应生成氢气的质量为x,消耗的硫酸的质量为y
Zn+H2SO4═ZnSO4+H2↑
65 98 2
30g y x
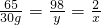
x=0.92g,y=45.23g
故这种硫酸中溶质的质量分数为: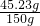 ×100%=30.15%
×100%=30.15%
答:可制得氢气0.92g,硫酸溶液中溶质的质量分数为30.15%.
分析:(1)根据题中的反应原理写出硫酸和锌反应的方程式,然后根据题中的锌的质量解出生成的氢气的量;
(2)根据锌的质量求出参加反应的硫酸的质量,然后根据溶质质量分数的计算方法计算硫酸溶液中溶质的质量分数.
点评:在解此类题时,首先要分析题中的反应原理,书写方程式,找出比例关系,解出需要的数据.
Zn+H2SO4═ZnSO4+H2↑
65 98 2
30g y x
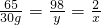
x=0.92g,y=45.23g
故这种硫酸中溶质的质量分数为:
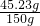 ×100%=30.15%
×100%=30.15%答:可制得氢气0.92g,硫酸溶液中溶质的质量分数为30.15%.
分析:(1)根据题中的反应原理写出硫酸和锌反应的方程式,然后根据题中的锌的质量解出生成的氢气的量;
(2)根据锌的质量求出参加反应的硫酸的质量,然后根据溶质质量分数的计算方法计算硫酸溶液中溶质的质量分数.
点评:在解此类题时,首先要分析题中的反应原理,书写方程式,找出比例关系,解出需要的数据.

练习册系列答案
 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案
相关题目
除去下列物质中的少量杂质,所选用的试剂及反应类型均正确的是
| 选项 | 物质(括号内为杂质) | 试剂 | 反应类型 |
| A | H2O (H2O2) | 适量MnO2 | 分解反应 |
| B | CaO (CaCO3) | 适量H2O | 化合反应 |
| C | Fe (C) | 足量H2SO4 | 置换反应 |
| D | Na2SO4(MgCl2) | 适量NaOH溶液 | 复分解反应 |
- A.A
- B.B
- C.C
- D.D
