题目内容
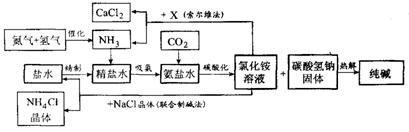
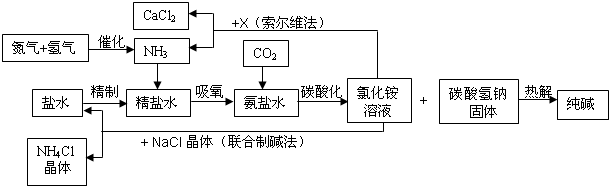
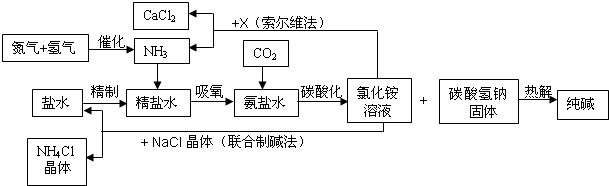
我国科学家侯德榜为我国纯碱和氮肥工业技术的发展做出了杰出的贡献.下图是侯氏联合制碱法和西方索尔维制碱法的工艺流程.已知有关物质重要反应的化学方程式如下:
2NH4Cl+X═2NH3↑+CaCl2+2H2O NH4Cl
NH3↑+HCl↑
根据以上信息回答下列问题.
(1)盐水精制的过程是除去溶液中各种杂质的过程.为将盐水中含有的MgCl2沉淀除去,可以向其中加入过量的烧碱.此时反应的化学方程式为______,将混合液中不溶物除去的实验方法是______;溶液中多余烧碱可以加______(填试剂名称)来除去,反应的化学方程式为______.
(2)氨碱工业最关键的一步是:在加压的条件下不断向饱和的氨盐水中通入二氧化碳气体,溶液中会有碳酸氢钠晶体析出.试分析该流程需要“加压”的原因是:______.
(3)在氨碱工业的历史上,如何处理流程中剩余的氯化铵溶液,出现了两种工艺:一是“索尔维法”,即在氯化铵溶液中加入物质X______(填化学式),产生了可循环使用的氨气和大量固体废弃物氯化钙;二是我国化学家侯德榜发明的“联合制碱法”,即在氯化铵溶液中加入适量氯化钠晶体.降低了氯化铵的______,使氯化铵晶体单独析出得到另一种产品--氮肥.氯化钠溶液则可以循环利用.
(4)在氨碱工业处理剩余的氯化铵溶液时.为何不直接蒸发结晶析出氯化铵固体?
答:______.
2NH4Cl+X═2NH3↑+CaCl2+2H2O NH4Cl
| ||

根据以上信息回答下列问题.
(1)盐水精制的过程是除去溶液中各种杂质的过程.为将盐水中含有的MgCl2沉淀除去,可以向其中加入过量的烧碱.此时反应的化学方程式为______,将混合液中不溶物除去的实验方法是______;溶液中多余烧碱可以加______(填试剂名称)来除去,反应的化学方程式为______.
(2)氨碱工业最关键的一步是:在加压的条件下不断向饱和的氨盐水中通入二氧化碳气体,溶液中会有碳酸氢钠晶体析出.试分析该流程需要“加压”的原因是:______.
(3)在氨碱工业的历史上,如何处理流程中剩余的氯化铵溶液,出现了两种工艺:一是“索尔维法”,即在氯化铵溶液中加入物质X______(填化学式),产生了可循环使用的氨气和大量固体废弃物氯化钙;二是我国化学家侯德榜发明的“联合制碱法”,即在氯化铵溶液中加入适量氯化钠晶体.降低了氯化铵的______,使氯化铵晶体单独析出得到另一种产品--氮肥.氯化钠溶液则可以循环利用.
(4)在氨碱工业处理剩余的氯化铵溶液时.为何不直接蒸发结晶析出氯化铵固体?
答:______.
(1)烧碱是氢氧化钠,氢氧化钠与氯化镁反应生成氢氧化镁沉淀和氯化钠;过滤是把不溶于液体的固体与液体分开的操作,所以除去液体混合物中的不溶性杂质用过滤的方法;盐酸能和过量的氢氧化钠反应生成氯化钠、水,用盐酸除去多余的氢氧化钠不会产生新杂质;
(2)二氧化碳能溶于水,但溶解性较差,气体的溶解度随压强的增大而增大,为了促进更多二氧化碳溶解,使反应更充分,所以需加压;
(3)铵盐与碱性物质反应生成氨气,在氯化铵溶液中加入物质X产生了可循环使用的氨气,定是加入碱性物质;又因为该反应生成氯化钙,所以加入的物质是熟石灰;氯化钠溶液和氯化铵溶液中都含氯离子,所以在氯化铵溶液中加入适量氯化钠晶体可降低氯化铵的溶解度,使氯化铵晶体单独析出;
(4)不直接蒸发结晶析出氯化铵固体,是因氯化铵受热易分解,这从题目所给信息可以知道;
故答案为:
(1)MgCl2+2NaOH═Mg(OH)2↓+2NaCl; 过滤;
盐酸; NaOH+HCl═NaCl+H2O;
(2)增大二氧化碳的溶解度,使反应更充分;
(3)Ca(OH)2;溶解度;
(4)氯化铵受热易分解.
(2)二氧化碳能溶于水,但溶解性较差,气体的溶解度随压强的增大而增大,为了促进更多二氧化碳溶解,使反应更充分,所以需加压;
(3)铵盐与碱性物质反应生成氨气,在氯化铵溶液中加入物质X产生了可循环使用的氨气,定是加入碱性物质;又因为该反应生成氯化钙,所以加入的物质是熟石灰;氯化钠溶液和氯化铵溶液中都含氯离子,所以在氯化铵溶液中加入适量氯化钠晶体可降低氯化铵的溶解度,使氯化铵晶体单独析出;
(4)不直接蒸发结晶析出氯化铵固体,是因氯化铵受热易分解,这从题目所给信息可以知道;
故答案为:
(1)MgCl2+2NaOH═Mg(OH)2↓+2NaCl; 过滤;
盐酸; NaOH+HCl═NaCl+H2O;
(2)增大二氧化碳的溶解度,使反应更充分;
(3)Ca(OH)2;溶解度;
(4)氯化铵受热易分解.

练习册系列答案
相关题目
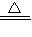 NH3↑+HCl↑
NH3↑+HCl↑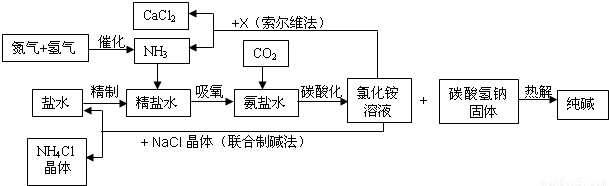
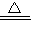 NH3↑+HCl↑
NH3↑+HCl↑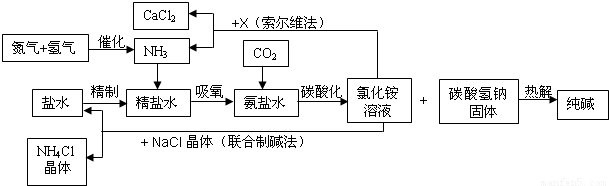
 == NH3↑+HCl↑
== NH3↑+HCl↑