题目内容
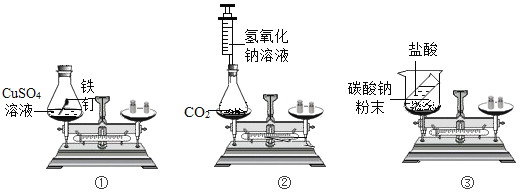
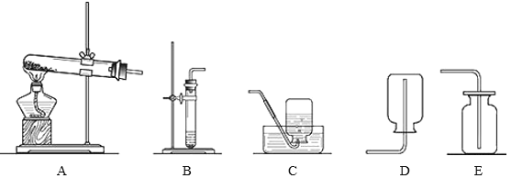
【题目】下图是实验室制取气体的部分装置。回答以下问题:
(1)制取气体前,应首先检查_____。
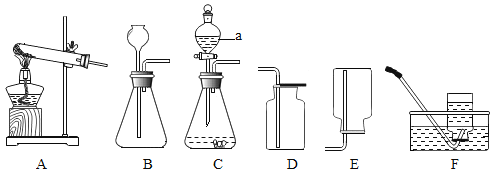
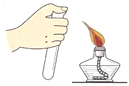
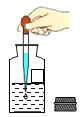
(2)实验室用过氧化氢溶液制取氧气的发生装置_____,要收集一瓶干燥的氧气,应选择收集装置_____,要收集一瓶比较纯净的氧气,应选择收集装置_____(填字母)。该反应的文字表达式:_____
(3)实验室用氯酸钾和二氧化锰的混合物制取氧气的发生装置_____,二氧化锰在反应中起_____作用,该反应的文字表达式:_____
(4)工业制氧是_____变化,实验室制氧是_____变化。(填物理或化学)
【答案】该装置气密性 B E C 过氧化氢![]() 水+氧气 A 催化 氯酸钾
水+氧气 A 催化 氯酸钾![]() 氯化钾+氧气 物理 化学
氯化钾+氧气 物理 化学
【解析】
(1)制取气体前,要先检查该装置气密性;
(2)实验室用过氧化氢制取氧气,属于固液常温型,应选择的发生装置是B,要收集一瓶干燥的氧气,应选择装置E;用排水法收集的气体比较纯净,实验室要收集一瓶比较纯净的氧气应选择C,该反应的文字表达式:过氧化氢![]() 水+氧气;
水+氧气;
(3)同学在实验室用氯酸钾和二氧化锰的混合物制取氧气属于固体加热型,故可选择的气体发生装置是A,二氧化锰在反应中起催化作用,该反应的文字表达式:氯酸钾![]() 氯化钾+氧气;
氯化钾+氧气;
(4)工业制取氧气采用分离液态空气法,反应中无新物质生成是物理变化,而实验室采用高锰酸钾制氧气有新物质生成是化学变化。

【题目】某同学为了测定石灰石中钙元素的含量(假设石灰石中除CaCO3含钙元素外,杂质不含钙元素、且不溶于水、不与酸反应),进行如下实验:称取20g石灰石样品放入烧杯中,将80g稀盐酸分4等份,分4次加入烧杯中,充分反应后称量。所得数据如下:
次 数 | 1 | 2 | 3 | 4 |
每次加入稀盐酸的质量/g | 20 | 20 | 20 | 20 |
充分反应后烧杯中物质的质量/g | 37.8 | 55.6 | 74.5 | 94.5 |
(1)充分反应后共生成CO2的质量为__________g。
(2)求样品中含CaCO3的质量_______(列化学方程计算)。
(3)该石灰石中钙元素的质量分数为____________。