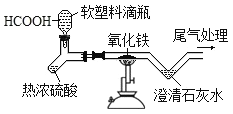
题目内容
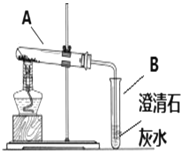
【题目】请根据下图所示的实验过程和提供的数据,试回答下列问题:
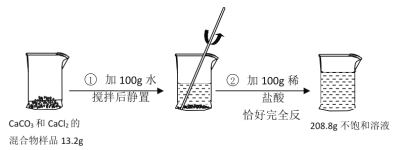
(1)在第②步实验操作中,观察到的一项实验现象是____。
(2)计算原混合物样品中CaCl2的质量____(写出计算过程,结果精确至0.1g)。
(相对原子质量:Ca-40,C-12,O-16,H-1,Cl-35.5)
【答案】产生气泡 3.2g
【解析】
(1)在第②步实验操作中,碳酸钙与盐酸反应生成氯化钙、二氧化碳和水,看到的现象是烧杯内产生气泡,故填产生气泡。
(2)解:生成二氧化碳的质量为13.2g+100g+100g208.8g=4.4g
设原混合物样品中CaCO3的质量为x
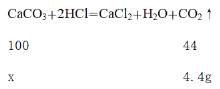
100:44=x:4.4g
x=10g
原混合物样品中CaCl2的质量为13.2g10g=3.2g
答:原混合物样品中CaCl2的质量为3.2g。

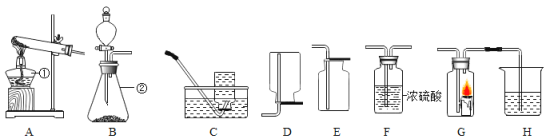
【题目】某中学化学兴趣小组按照课本实验方法,做木炭与氧化铜反应实验。请写出木炭与氧化铜反应化学方程式:______。实验时,同学们发现很难观察到紫红色铜的生成,却往往观察到有暗红色固体出现。请你参与探究木炭与氧化铜反应得到的暗红色固体的成分,完成下列各题:
已知信息:Ⅰ.木炭与氧化铜反应除生成铜外还可能生成氧化亚铜(Cu2O);
Ⅱ.Cu和Cu2O均为不溶于水的固体;
Ⅲ.Cu2O+H2SO4=CuSO4+Cu+H2O
提出问题:红色固体含有什么物质?
(1)猜想假设:猜想一:红色固体只含Cu;猜想二:红色固体只含Cu2O;猜想三:______(请补充完成猜想三)。
(2)实验探究:(填写表中空格)
实验操作 | 实验现象 | 实验结论 |
a.取少量红色固体加入到足量硫酸溶液中 | 无明显现象 | 假设 ______ 成立 |
b.取少量红色固体加入到足量硫酸溶液中 | ______ | 假设二和假设三均有可能成立 |
(3)试管B中看到的现象是:______,反应的化学方程式:______。