��Ŀ����
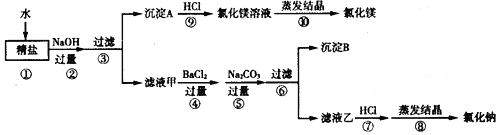
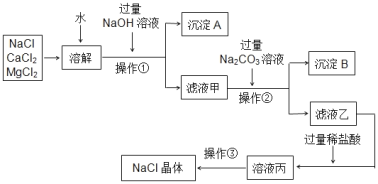
����Ŀ��ij������Ʒ�к��������Ȼ�þ���Ȼ��ƣ�ijͬѧ����������ᴿ������
��ش��������⣺
��1�����������NaOH��Һ��Ŀ����Ϊ�˳�ȥ�����е�_____�����������ƣ�����Ӧ�Ļ�ѧ����ʽΪ_____��
��2�����������Na2CO3��Һ��Ŀ����_____����Ӧ�Ļ�ѧ����ʽΪ_____��
��3����Һ���к��е�������_____������Һ���м��������������кͷ�Ӧ�Ļ�ѧ����ʽΪ_____��
��4��������������Ϊ_____���ڸò����У���Ҫ�õ������������żܡ��ƾ��ơ�������������ǯ��_____��
��5���������ᴿ��õ����Ȼ��Ʊ�ԭ����Ʒ�е��Ȼ��Ƶ�������_____������ࡱ�������١����䡱����
���𰸡��Ȼ�þ 2NaOH+MgCl2��Mg��OH��2��+2NaCl ��ȥ�Ȼ��� CaCl2+NaCO3��CaCO3��+2NaCl �������ơ�̼���ƺ��Ȼ��� NaOH+HCl��NaCl+H2O ���� ������ ����
��������
��1���������ƺ��Ȼ�þ��Ӧ����������þ�������Ȼ��ƣ����Լ��������NaOH��Һ��Ŀ����Ϊ�˳�ȥ�����е��Ȼ�þ����ѧ����ʽΪ��2NaOH+MgCl2��Mg��OH��2��+2NaCl������Ȼ�þ 2NaOH+MgCl2��Mg��OH��2��+2NaCl����
��2��̼���ƺ��Ȼ��Ʒ�Ӧ����̼��Ƴ������Ȼ��ƣ����Լ��������Na2CO3��Һ��Ŀ���dz�ȥ�Ȼ��ƣ���ѧ����ʽΪ��CaCl2+NaCO3��CaCO3��+2NaCl�������ȥ�Ȼ��� CaCl2+NaCO3��CaCO3��+2NaCl��
��3�������̼���ƺ����������ǹ����ģ�������Һ���к��е��������������ơ�̼���ƺ��Ȼ��ƣ��������ƺ����ᷴӦ�����Ȼ��ƺ�ˮ�����Ӧ���кͷ�Ӧ����ѧ����ʽΪ��NaOH+HCl��NaCl+H2O������������ơ�̼���ƺ��Ȼ��� NaOH+HCl��NaCl+H2O��
��4������Һ�еĹ���ķ��������������Բ��������������ڸò����У���Ҫ�õ������������żܡ��ƾ��ơ�������������ǯ��������ȱ����������� ������
��5���ڳ��ӹ����л�����һ�����Ȼ��ƣ����Ծ������ᴿ��õ����Ȼ��Ʊ�ԭ����Ʒ�е��Ȼ��Ƶ����������࣬������ࡣ

 ��1����Ԫ�¿�������ĩϵ�д�
��1����Ԫ�¿�������ĩϵ�д�