题目内容
【题目】请根据下列仪器装置图,回答有关问题:
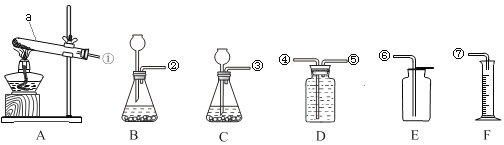
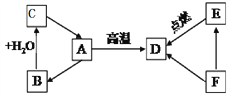
(1)实验室制取二氧化碳时选择C为发生装置而不选择B的原因__________________。在安装好仪器、加入试剂前,应该进行的操作是_________(填操作名称),写出实验室制取二氧化碳的反应方程式__________________ 。
(2)实验室用高锰酸钾制取氧气时,将装置________(填字母)和F连接可以收集氧气并测其体积,则收集氧气装置的气体进口是______(填数字)。写出用高锰酸钾制取氧气的化学反应方程
___________________________________。
(3)实验室常用加热氯化铵和氢氧化钙的固体混合物来制取氨气,应选用的发生装置是_____(填字母),理由是_______________。
【答案】 长颈漏斗下端管口没有伸到液面下,会使生成的气体从其逸出 检查装置的气密性 CaCO3+2HCl====CaCl2+H2O+CO2↑ D ⑤ 2KMnO4![]() K2MnO4+MnO2+O2↑ A 可以加热
K2MnO4+MnO2+O2↑ A 可以加热
【解析】根据实验室常见气体发生装置的选择与反应物的状态和反应条件有关、收集装置与气体的密度和溶解性有关,结合气体制取的步骤和注意事项解答即可。(1)据图可以看出,B装置的长颈漏斗没有浸没到液面以下,会导致生成的气体逸出,组装好仪器应该先检查装置的气密性,实验室使用碳酸钙和稀盐酸反应生成氯化钙、水和二氧化碳,反应的化学方程式为CaCO3+2HCl═CaCl2+H2O+CO2↑;(2)实验室用高锰酸钾制取氧气时,要测定收集到的氧气的体积,可以将装置D与F连接,通过排出的水的体积测定氧气的体积,实质就是排水法收集氧气,故进气口是⑤,反应的化学方程式为2KMnO4△K2MnO4+MnO2+O2↑;(3)实验室常用加热氯化铵和氢氧化钙的固体混合物来制取氨气,是固体加热型反应,故选择A装置作为发生装置。

【题目】常温下,小明同学在练习“金属的化学性质”实验操作时,发现几支试管中冒出气泡的速率有快有慢,于是他与小芳同学一起合作进行如下探究。
【提出问题】金属与酸反应的快慢受哪些因素影响呢?
【猜想与假设】A.可能与酸的浓度有关;B.可能与金属的种类有关;C.可能与金属的形状有关。
【设计并实验】小明和小芳进行如下实验。
实验 编号 | 盐酸的 浓度 | 金属 (均取2 g) | 金属的 形状 | 收集50 mL 氢气所需要 的时间/s |
① | 10% | 镁 | 粉状 | 60 |
② | 10% | 铁 | 片状 | 120 |
③ | 10% | 镁 | 片状 | 102 |
④ | 20% | 铁 | 片状 | 110 |
(1)实验时需将镁片和铁片进行打磨,其目的是____________________________。
(2)写出铁与稀盐酸反应的化学方程式:________________________________。
【收集证据】
(3)要比较金属的种类对反应快慢的影响,应选择的实验编号是________。
【得出结论】通过上述四个实验,你得出的影响金属与酸反应的因素有____________________。
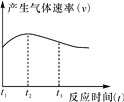
(4)实验①中试管外壁发烫,说明镁与稀盐酸反应是放热反应。实验测得镁与稀盐酸反应中产生气体的速率(v)与时间(t)的关系如图所示,你认为在t1~t2 时间段内反应速率逐渐加快的主要原因是_________________, t2~t3时间段内反应速率逐渐减慢的主要原因是___________________。
【题目】下列选项中物质的名称、俗名、化学式和类别完全一致的是
选项 | 名称 | 俗名 | 化学式 | 类别 |
A | 氧化钙 | 熟石灰 | CaO | 氧化物 |
B | 氯化钠 | 盐 | NaCl | 盐类 |
C | 过氧化氢 | 双氧水 | H2O2 | 水 |
D | 氢氧化钙 | 消石灰 | Ca(OH)2 | 碱 |
A.AB.BC.CD.D