题目内容
近日,电影《泰坦尼克号》3D版重现荧屏,掀起一股观影狂潮.这艘号称“永不沉没的巨轮”,在建造的过程中使用了数以万吨的钢铁.钢铁是生活中使用最多的金属材料.
(1)生铁和钢都是铁合金,其中含碳量较高的是
(2)在炼铁高炉中将赤铁矿(主要成分Fe2O3)还原为铁的主要化学方程式是
(3)铝、铜、铁是人类广泛使用的三种金属,现在只有铁丝,用下列试剂验证这三种金属的活动性顺序,能达到目的是
A.硫酸铝溶液 B.硫酸亚铁溶液 C.硫酸铜溶液
(4)将一定质量氧化铜加入稀硫酸中完全溶解后,再加入铁粉充分反应,过滤,再将滤渣加入足量稀硫酸中,有气泡冒出,充分反应后,剩余固体物质的质量为6.4g,原氧化铜的质量为
(1)生铁和钢都是铁合金,其中含碳量较高的是
生铁
生铁
.(2)在炼铁高炉中将赤铁矿(主要成分Fe2O3)还原为铁的主要化学方程式是
Fe2O3+3CO
2Fe+3CO2
| ||
Fe2O3+3CO
2Fe+3CO2
.
| ||
(3)铝、铜、铁是人类广泛使用的三种金属,现在只有铁丝,用下列试剂验证这三种金属的活动性顺序,能达到目的是
AC
AC
(填序号).A.硫酸铝溶液 B.硫酸亚铁溶液 C.硫酸铜溶液
(4)将一定质量氧化铜加入稀硫酸中完全溶解后,再加入铁粉充分反应,过滤,再将滤渣加入足量稀硫酸中,有气泡冒出,充分反应后,剩余固体物质的质量为6.4g,原氧化铜的质量为
8
8
g.分析:(1)依据生铁与钢的含碳量分析解答;
(2)依据赤铁矿在高炉中发生氧化铁和一氧化碳的反应书写即可;
(3)若要验证三种金属的活动性,取三种金属中中间金属与两端金属的盐溶液反应.
(4)根据金属活动性由强到弱的顺序:铁>氢>铜,分析氧化铜中加入稀硫酸发生的反应(CuO+H2SO4=CuSO4+H2O),再加入铁粉可能发生的反应(Fe+CuSO4=FeSO4+Cu、Fe+H2SO4=FeSO4+H2↑),依据实验现象“滤渣中加入足量稀硫酸中,有气泡冒出”,判断发生反应后所得滤渣和滤液的成分,并进而利用氧化铜与铜的关系计算即可.
(2)依据赤铁矿在高炉中发生氧化铁和一氧化碳的反应书写即可;
(3)若要验证三种金属的活动性,取三种金属中中间金属与两端金属的盐溶液反应.
(4)根据金属活动性由强到弱的顺序:铁>氢>铜,分析氧化铜中加入稀硫酸发生的反应(CuO+H2SO4=CuSO4+H2O),再加入铁粉可能发生的反应(Fe+CuSO4=FeSO4+Cu、Fe+H2SO4=FeSO4+H2↑),依据实验现象“滤渣中加入足量稀硫酸中,有气泡冒出”,判断发生反应后所得滤渣和滤液的成分,并进而利用氧化铜与铜的关系计算即可.
解答:解:(1)生铁和钢的本质区别是含碳量不同,生铁为2%~4.3%,钢为0.03%~2%.故含碳量较高的是生铁.
(2)在炼铁高炉中将赤铁矿(主要成分Fe2O3)还原为铁的主要化学反应是氧化铁与一氧化碳反应生成铁与二氧化碳,化学方程式是Fe2O3+3CO
2Fe+3CO2;
(3)验证三种金属的活动性,取三种金属中中间金属与两端金属的盐溶液反应,所以硫酸铝溶液和硫酸铜溶液;
(4)根据实验现象“滤渣中加入足量稀硫酸中,有气泡冒出”可知,充分反应后滤渣中含有铁,说明加入的铁是过量的;此时滤液中不存在硫酸和硫酸铜,则所得滤渣中一定含有铜、铁,滤液中一定含有硫酸亚铁;将滤渣中加入足量稀硫酸中,充分反应后,剩余固体物质为铜,铜的质量为6.4g;根据元素质量守恒,由铜的质量可以计算出参加反应的氧化铜的质量.
设氧化铜的质量是x
Cu---CuO
64 80
6.4g x
=
x=8g.
故答案为:(1)生铁;(2)Fe2O3+3CO
2Fe+3CO2;(3)AC;(4)8.
(2)在炼铁高炉中将赤铁矿(主要成分Fe2O3)还原为铁的主要化学反应是氧化铁与一氧化碳反应生成铁与二氧化碳,化学方程式是Fe2O3+3CO
| ||
(3)验证三种金属的活动性,取三种金属中中间金属与两端金属的盐溶液反应,所以硫酸铝溶液和硫酸铜溶液;
(4)根据实验现象“滤渣中加入足量稀硫酸中,有气泡冒出”可知,充分反应后滤渣中含有铁,说明加入的铁是过量的;此时滤液中不存在硫酸和硫酸铜,则所得滤渣中一定含有铜、铁,滤液中一定含有硫酸亚铁;将滤渣中加入足量稀硫酸中,充分反应后,剩余固体物质为铜,铜的质量为6.4g;根据元素质量守恒,由铜的质量可以计算出参加反应的氧化铜的质量.
设氧化铜的质量是x
Cu---CuO
64 80
6.4g x
| 64 |
| 6.4g |
| 80 |
| x |
x=8g.
故答案为:(1)生铁;(2)Fe2O3+3CO
| ||
点评:“三取中”检验金属活动性强弱的方法为:取三种金属中中间金属与两端金属的盐溶液反应或取中间金属的盐溶液与两端金属反应.

练习册系列答案
相关题目
 近日,电影《泰坦尼克号》3D版重现荧屏,掀起一股观影狂潮.这艘号称“永不沉没的巨轮”,在建造的过程中使用了数以万吨的钢铁.钢铁是生活中使用最多的金属材料.
近日,电影《泰坦尼克号》3D版重现荧屏,掀起一股观影狂潮.这艘号称“永不沉没的巨轮”,在建造的过程中使用了数以万吨的钢铁.钢铁是生活中使用最多的金属材料.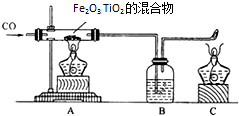 材料:人类要在月球居住,首先离不开淡水和氧气,而月球上既没有水又没有空气.科学家发现月球的沙土中含有丰富的含氧钛铁矿,成分为TiO2、Fe2O3的混合物,若将这些矿石利用CO来还原可以提炼单质钛和铁,若用氢气还原,可以得到淡水.若将这些矿石通电,还可以从中分离出氧气.
材料:人类要在月球居住,首先离不开淡水和氧气,而月球上既没有水又没有空气.科学家发现月球的沙土中含有丰富的含氧钛铁矿,成分为TiO2、Fe2O3的混合物,若将这些矿石利用CO来还原可以提炼单质钛和铁,若用氢气还原,可以得到淡水.若将这些矿石通电,还可以从中分离出氧气. 近日,电影《泰坦尼克号》3D版重现荧屏,掀起一股观影狂潮.这艘号称“永不沉没的巨轮”,在建造的过程中使用了数以万吨的钢铁.钢铁是生活中使用最多的金属材料.
近日,电影《泰坦尼克号》3D版重现荧屏,掀起一股观影狂潮.这艘号称“永不沉没的巨轮”,在建造的过程中使用了数以万吨的钢铁.钢铁是生活中使用最多的金属材料.