题目内容
下列变化属于化学变化的是( )
A. 石蜡熔化 B. 潮湿的衣服被晒干了
C. 钢铁生锈 D. 水变成水蒸气
练习册系列答案
相关题目
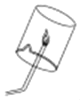
对下列实验指定容器中的水,其解释没有体现水的主要作用的是( )
A | B | C | D | |
实验装置 |
硫在氧气中燃烧 |
测定空气中氧气含量 |
铁丝在氧气中燃烧 |
排水法收集氧气 |
解释 | 集气瓶中的水: 吸收放出的热量 | 量筒中的水: 通过水体积的变化得出氧气体积 | 集气瓶中的水: 冷却溅落熔融物,防止集气瓶炸裂 | 集气瓶中的水: 排出瓶内的空气 |
A. A B. B C. C D. D