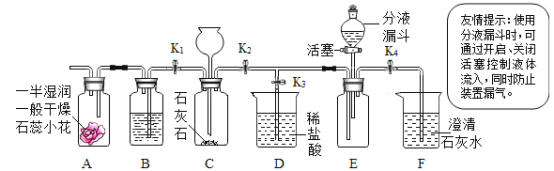
题目内容
【题目】认真分析下图回答有关问题:
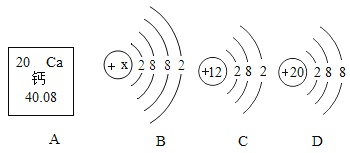
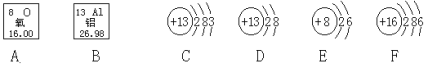
(1)图A为钙元素在元素周期表中的部分信息,由此可知钙元素为____________(填“金属”或“非金属”)元素。
(2)图B为钙原子的结构示意图,分析后回答:
①x的数值为________________;
②钙原子在化学反应中容易______________(填“失去”或“得到”)电子,这一性质与C.、D中的_______________相似。
(3)D所表示的粒子符号是______________。
【答案】金属 20 失去 C Ca2+
【解析】
(1)钙是“金”字旁,属于金属元素,故填写:金属;
(2)由图B可知,钙原子核外电子数为:2+8+8+2=20,根据原子的核内质子数=核外电子数可得,x=20,故填写:20;
钙原子最外层有2个电子,小于4,易失去电子,故填写:失去;
根据最外层电子数相同,化学性质相似的原则可得,C的最外层有2个电子,与钙原子化学性质相似,故填写:C;
(3)D所表示的粒子,核外电子数为:2+8+8=18,小于核电荷数20,属于阳离子,且原子序数也为20,因此,是带两个正电荷的钙离子,故填写:Ca2+。

【题目】在日常生活和工农业生产中,溶液有着广泛的应用。
I.在农业上通常用12%的氯化钠溶液选种。实验室欲配制该质量分数的溶液60g,操作如下图,请回答下列问题:
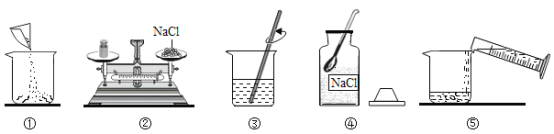
(1)请用图中的序号表示配制溶液的正确操作顺序____________。
(2)认真观察②,改正其中的错误操作:_______________。若不进行改正,其他操作步骤正确,则所配溶液的溶质的质量分数_________(填“大于”“小于”或“等于”)10%。
(3)若配制所得的氯化钠溶液溶质质量分数偏小,可能的原因是_________。
A 用量筒量取水时俯视读数
B 烧杯用蒸馏水润洗后未等晾干就配制溶液
C 天平指针偏右就开始称量
D 转移已配好的溶液时,有少量溶液溅出
E 转移已称好的氯化钠固体时,部分洒落在烧杯外
II.我们知道“海水制碱”工业用到的是饱和食盐水,医疗上使用的则是0.9%的生理盐水。请按要求设计并完成以下实验:
实验用品:氯化钠溶液、氯化钠、硝酸钾、蒸馏水、烧杯、试管、玻璃棒、药匙。
探究实验一:澄清透明的氯化钠溶液是否是饱和溶液
实验步骤 | 实验现象 | 实验结论 |
取一只试管倒入约5mL氯化钠溶液,用药匙加入少量氯化钠固体,振荡,观察现象。 | 氯化钠固体溶解 | _________ |
探究实验二:将不饱和氯化钠溶液变为饱和溶液并探究饱和氯化钠溶液还能否溶解硝酸钾固体
实验步骤 | 实验现象 | 实验结论 |
_________ | _________ | NaCl不饱和溶液变为饱和溶液 |
_________ | _________ | _________ |
请完成上面表格
【题目】小雨阅读课外资料得知:氯酸钾的分解可用二氧化锰、氧化铜等物质作催化剂。于是,他对影响氯酸钾分解的因素及催化剂的催化效果产生了探究兴趣。
(提出问题)氧化铜是否比二氧化锰催化效果更好?影响氯酸钾分解速率的因素有哪些呢?
(设计实验)小雨以生成等体积的氧气为标准,设计了下列几组实验。
序号 | KClO3的质量 | 其他物质的质量 | 温度 | 氧气的体积 | 反应所需时间 |
① | 10.0g | 330℃ | 100mL | t1 | |
② | 10.0g | CuO1.5g | 330℃ | 100mL | t2 |
③ | 10.0g | MnO21.5g | 330℃ | 100mL | t3 |
④ | 10.0g | MnO2_____g | 380℃ | 100mL | t4 |
(1)若t1>t2,说明氧化铜能加快氯酸钾的分解速率。若要确定氧化铜是此反应的催化剂,还需探究反应前后,氧化铜的_____和_____不变。
(2)写出实验④所涉及的化学反应的文字表达式_____。
(3)实验④中MnO2的质量为_____g,若t3>t4,则化学反应快慢与温度的关系是_____。
(4)氯酸钾的分解速率可能还与_____因素有关,请设计实验证明_____。