题目内容
【题目】(6分)某化学兴趣小组为测定某石灰石样品(杂质不溶于水,也不与酸反应)中碳酸钙的质量分数,进行如图所示的实验。
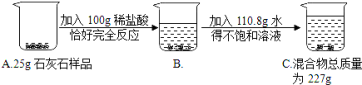
请根据以上信息回答下列问题:
(1)写出反应的化学方程式 ;
(2)列出求解该样品中参加反应的碳酸钙质量(x)的比例式 ;
(3)该样品中碳酸钙的质量分数为 ;
(4)所得不饱和溶液中溶质的质量分数为 ;
(5)欲配制150g上述实验所用的稀盐酸,需要36.5%的浓盐酸质量为 。
【答案】(1)CaCO3 + 2HCl==CaCl2 + CO2↑+H2O(2)100:44=X:8.8g;(3)80%;(4)10%(5)60 g
【解析】
试题分析:根据质量守恒定律可以知道产生的二氧化碳的质量是=100+25+110.8-227=8.8克;设参加反应的碳酸钙的质量为 X ,生成的氯化钙的质量为Y,需要盐酸的质量为Z,
CaCO3 + 2HCl==CaCl2 + CO2↑ + H2O
100 73 111 44
X Z Y 8.8克
列比例式得:100:X=73:Z=111:Y=44:8.8克 求得X=20克 Y=22.2克 Z=14.6克
碳酸钙的质量分数为=20/25×100%=80% ,所得不饱和溶液中溶质的质量分数=22.2/(227-5)×100%=10%;
需要的盐酸的质量分数=14.6克/100×100%=14.6%,设需要36.5%的浓盐酸质量为W,则:150×14.6%=36.5%W,解得W=60.

练习册系列答案
相关题目