题目内容
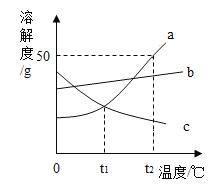
【题目】下图中表示中学几种常见的物质在一定条件下可以转化,A是石灰石的主要成分,E、G为黑色的粉末,C为最常见的无色液体,H为亮红色固体。(部分条件省略)
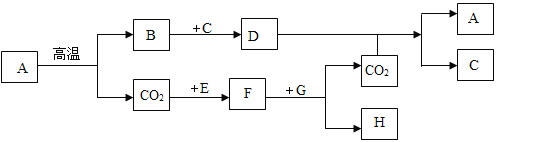
(1)写出下列物质的化学式:A_____B_____H_____
(2)D物质和CO2反应的方程式为:_____
(3)F和G物质反应的实验现象为_____
【答案】CaCO3 CaO Cu ![]() 黑色固体逐渐变为亮红色,生成一种使澄清石灰水变浑浊的气体
黑色固体逐渐变为亮红色,生成一种使澄清石灰水变浑浊的气体
【解析】
A是石灰石的主要成分,所以A是碳酸钙,碳酸钙高温会生成氧化钙和二氧化碳,所以B是氧化钙,C为无色液体,可以和氧化钙反应产生D,所以C是水,D是氢氧化钙,氢氧化钙和二氧化碳反应产生碳酸钙沉淀和水,E、G为黑色的粉末,E和二氧化碳反应产生F,F和G反应产生二氧化碳和H,H为紫红色固体,所以E是碳,F是一氧化碳,一氧化碳和氧化铜反应产生铜和二氧化碳,所以H为铜,G是氧化铜,经过验证,推导正确。
(1)由上分析可知A是CaCO3;B是CaO;H是Cu;
故填:CaCO3;CaO;Cu;
(2)D是氢氧化钙,氢氧化钙和二氧化碳反应生成碳酸钙沉淀和水,反应的方程式为:![]() ,故填:
,故填:![]() ;
;
(3)F和G反应是一氧化碳和氧化铜在加热条件下反应生成铜和二氧化碳,反应的实验现象是:黑色固体逐渐变为亮红色,生成一种使澄清石灰水变浑浊的气体。
故填:黑色固体逐渐变为亮红色,生成一种使澄清石灰水变浑浊的气体。

 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案【题目】金属镁可与热水反应生成氢氧化镁和氢气,所得溶液呈碱性,可使酚酞溶液显红色。某同学将镁条放在水中煮沸,趁热取出部分溶液,滴加酚酞溶液,变为红色,放置在空气中一段时间后,发现溶液的红色褪去了。
(1)镁与热水反应的化学方程式是_____。
(2)查阅资料:溶液红色褪去的原因是溶液碱性减弱。
[提出问题]导致溶液碱性减弱的原因是什么?
[假设与分析]
假设1:可能是氢氧化镁与N2或O2发生了反应。
假设2:可能是溶液吸收了空气中的_____。
假设3:可能是氢氧化镁的溶解度随温度的降低而_____。
由碱的性质可知,假设1不成立。
[实验探究]
实验操作 | 实验现象 | 结论 |
1.取上述红色溶液,保持温度不变。在空气中放置一段时间,观察现象。 | _____。 | 假设2成立 |
2.取上述红色溶液,_____观察现象。 | 红色褪去 | 假设3成立 |
[拓展延伸]
(3)将一小块金属钠投人硫酸铜溶液时。产生蓝色沉淀。请解释其原因:_____。
(4)除上述金属外,根据金属活动性顺序,预测_____也能跟硫酸铜溶液反应产生上述现象(举一例即可)。