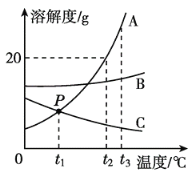
题目内容
【题目】(探究一):空气中氧气含量的再测定
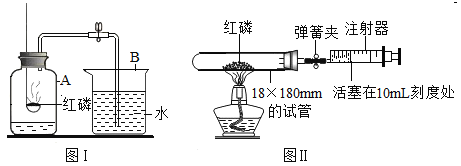
(1) 实验原理:由于红磷燃烧消耗空气中的氧气,使瓶内________减小,烧杯中水倒吸到集气瓶。能粗略测出空气中氧气的含量。

(问题提出)有实验资料表明:燃烧过程中当氧气体积分数低于7% 时,红磷就无法继续燃烧,因此通过上述实验,结果与存在一定的误差。
(实验改进)
Ⅰ. 根据铁在空气中生锈的原理设计图10实验装置,再次测定空气中氧气含量。饱和食盐水、活性炭会_____铁生锈。
(填:加快或减慢)
Ⅱ.测得实验数据如表4

(2)铁生锈过程发生复杂的化学反应,首先是铁与氧气、水反应生成氢氧化亚铁[Fe(OH)2],写出该反应的化学式表达式____________________________________
(3)根据表4计算,改进后测得的空气中氧气的体积分数是____(计算精确到0.1%)。
(4)从实验原理角度分析,改进后的实验结果比前者准确度更髙的原因是:
_________________________(写一点即可)
(探究二)实验室制取二氧化碳药品的选择
某研究小组在实验室制取二氧化碳的研究中发现,通常不选用大理石与稀硫酸反应制取二氧化碳,其原因是反应生成硫酸钙微溶物覆盖在固体的表面,阻碍了大理石与稀硫酸的接触,反应速率逐渐减慢甚至停止。为此,该小组设立研究课题:选择合适浓度的硫酸和适当的反应温度制取二氧化碳.
[实验一] 选择合适浓度的硫酸
操作:在28℃时,用装有5mL硫酸溶液的注射器向盛有lg直径为2mm大理石的大试管中注入硫酸,记录15分钟内生成气体的体积,见下表:
试管编号 | 1 | 2 | 3 | 4 | 5 |
硫酸浓度(%) | 15 | 20 | 25 | 30 | 35 |
气体体积(mL) | 35 | 47 | 55 | 51 | 42 |
[实验二] 选择合适的反应温度
操作:往盛有lg直径为2mm大理石的大试管中分别加入5mL相同合适浓度而不同温度的硫酸溶液,观察反应的情况,记录如下表:
试管编号 | A | B | C | D | E |
温度(℃) | 40 | 50 | 60 | 70 | 80 |
现象和比较 | 有少量 气泡 | 气泡比A 号试管多 | 气泡明显比B号试管多 | 大量气泡产生,与常温用盐酸反应相似 | 反应激烈,迅速产生大量气体 |
回答:
(5)稀硫酸与大理石反应,在28℃时,选用硫酸的浓度最合适为____%,因为浓度小于或大于合适浓度对反应的影响是_________________________________.
(6)在合适的硫酸浓度下,应选择最合适的反应温度为______℃,因为温度高于或低于该温度对反应的影响是_____________________________________.
(7)除选用适当的温度和合适浓度的硫酸之外,在反应过程中,为防止硫酸钙覆盖在大理石上,应增加________________________操作,更有利于气体的制备。
(8)该研究小组为了研究__________________对该反应速率的影响,进行了如下实验
试管编号 | A | B |
试管内药品 | 1g块状大理石与5mL25%稀硫酸 | 1g粉末状大理石与5mL25%稀硫酸 |
现象和比较 | 有少量气泡 | 迅速产生较多气泡 |
(9)大理石和稀硫酸反应生成硫酸钙、水和二氧化碳,试写出该反应的文字表达式_________。
【答案】气压;加快;Fe + H2O + O2 ![]() Fe(OH)220.2%铁的缓慢氧化使集气瓶中的氧气消耗更彻底,使实验结果更准确。测量时考虑到导管容积和扣除内容物后的集气瓶容积,使实验结果更准确。25%,生成气体体积较少70,温度过低,反应过慢,温度过高,反应剧烈,不利于气体的收集;大理石固体颗粒的大小等;碳酸钙+硫酸→硫酸钙+水+二氧化碳。
Fe(OH)220.2%铁的缓慢氧化使集气瓶中的氧气消耗更彻底,使实验结果更准确。测量时考虑到导管容积和扣除内容物后的集气瓶容积,使实验结果更准确。25%,生成气体体积较少70,温度过低,反应过慢,温度过高,反应剧烈,不利于气体的收集;大理石固体颗粒的大小等;碳酸钙+硫酸→硫酸钙+水+二氧化碳。
【解析】
(1)由于红磷燃烧消耗空气中的氧气,使瓶内气压减小,烧杯中水倒吸到集气瓶,若装置的气密性良好,操作规范,用量筒测量进入瓶中水的体积,能粗略测得空气中氧气的含量;
Ⅰ. 铁生锈是铁、氧气、水的共同作用,饱和食盐水、活性炭的存在会加快铁生锈;
Ⅱ. (2)铁生锈过程发生复杂的化学反应,首先是铁与氧气、水反应生成氢氧化亚铁[Fe(OH)2],该反应的化学式表达式Fe + H2O + O2 ![]() Fe(OH)2;
Fe(OH)2;
(3) 根据表4计算,改进实验后测得的空气中氧气的体积分数是![]() ×100%=20.2%;
×100%=20.2%;
(4)从实验原理角度分析,改进后的结果比教材实验准确度髙的原因是:铁生锈消耗氧气更彻底,计算集气瓶中空气体积时扣除了内容物的体积等;
(5)由表格中数据可知,稀硫酸与大理石反应,在28℃时,选用硫酸的浓度最合适为25%,此时的反应生成气体体积最大,当浓度小于或大于合适浓度对反应的影响是生成气体体积较少;
(6) 由表格中数据可知,40℃时,有少量气泡;50℃时,气泡比A,号试管多;60℃时,气泡明显比B号试管多;70℃时,大量气泡产生,与常温用盐酸反应相似;80℃时,反应激烈,迅速产生大量气体。因此在合适的硫酸浓度下,应选择最合适的反应温度为70℃,因为温度高于或低于该温度对反应的影响是温度过低,反应过慢,温度过高,反应剧烈,不利于气体的收集;
(7)除选用适当的温度和合适浓度的硫酸之外,在反应过程中,为防止硫酸钙覆盖在大理石上,应增加震荡或搅拌等操作,更有利于气体的制备;
(8)由表格中信息,对照试验A、B中除石灰石的颗粒大小不同,其都相同,可知该实验是研究大理石固体颗粒的大小等对该反应速率的影响;
(9)大理石和稀硫酸反应生成硫酸钙、水和二氧化碳,反应的文字表达式:碳酸钙+硫酸→硫酸钙+水+二氧化碳。

【题目】二氧化锰能作过氧化氢分解的催化剂,那么氧化铝是否也可作过氧化氢分解的
催化剂呢?请你一起参与他们的探究过程,并填写下列表格
(1)(问题)氧化铝能不能作过氧化氢分解的催化剂呢?
(2)(猜想)氧化铝能作过氧化氢分解的催化剂.
他设计并完成了下表所示的探究实验:
实验操作 | 实验现象 | 实验结论 | |
实验一 | 取 5mL15%的过氧化氢溶液于 试管中,伸入带火星的木条 | 有气泡产生,木条不复 燃 | 过氧化氢分解产生氧 气,但是反应______。 |
实验二 | 在盛水的试管中加入氧化铝,伸 入带火星的木条 | 没有明显现象 | _____ |
实验三 | ③_____ | ④_____ | _______ |
(1)老师认为要证明氧化铝是过氧化氢分解的催化剂还必须增加两个实验:
①实验操作中需要在实验前后两次称量氧化铝质量,其目的是_____
②利用实验三反应后试管内的剩余物继续实验,其实验操作、现象和结论是
实验操作 | 实验现象 | 实验结论 |
________ | ________ | ________ |
(2)写出实验三的化学反应的文字表达式:_____