题目内容
现有4.6g某物质在空气中完全燃烧,生成了8.8g CO2和5.4g H2O,该物质的化学式可能是( )
| A、C2H4 |
| B、C2H6 |
| C、CH3OH |
| D、C2H5OH |
考点:质量守恒定律及其应用
专题:化学用语和质量守恒定律
分析:根据题意“4.6g某物质在空气中完全燃烧,生成了8.8gCO2和5.4gH2O”及质量守恒定律反应前后元素的质量及种类不变可知,该物质一定含有碳、氢元素,可能含有氧元素.再根据二氧化碳的碳元素、水中氢元素的质量的和与1.6g的关系,判定氧元素的存在情况;最后根据各元素的质量和相对原子质量推出可能的化学式.
解答:解:
由质量守恒定律反应前后元素的种类不变,确定:该物质中一定含有碳、氢两种元素,可能含有氧元素.再根据反应前后元素的质量相等,来确定氧元素是否含有.8.8g二氧化碳中碳元素的质量为:8.8g×
×100%=2.4g,5.4g水中氢元素的质量为:5.4g×
×100%=0.6g.2.4g+0.6g=3.0g小于原物质的质量,故一定含氧元素,其质量为4.6g-3.0g=1.6g.碳、氢、氧元素的原子个数比为:
:
:
=2:6:1,所以,可能的化学式是:C2H5OH.
故选:D.
由质量守恒定律反应前后元素的种类不变,确定:该物质中一定含有碳、氢两种元素,可能含有氧元素.再根据反应前后元素的质量相等,来确定氧元素是否含有.8.8g二氧化碳中碳元素的质量为:8.8g×
| 12 |
| 44 |
| 2 |
| 18 |
| 2.4g |
| 12 |
| 0.6g |
| 1 |
| 1.6g |
| 16 |
故选:D.
点评:本题是运用化学中的基本思想质量守恒思想,学会处理此类计算的题目,从而培养了学生的创新思维能力.

练习册系列答案
 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案
相关题目
研究物质时,常常先把物质进行分类.下列物质中属于化合物的是( )
| A、氢气(H2) |
| B、二氧化碳(CO2) |
| C、蔗糖水 |
| D、碘酒 |
2013年世界地球日的主题是“多样的物种,唯一的地球,共同的未来”.下列描述符合这一主题的是( )
| A、雾霾是一种自然现象,对人体健康影响不大 |
| B、地球上的淡水资源非常丰富,取之不尽 |
| C、减少私家车使用次数,多乘公交车或骑自行车 |
| D、为了增加粮食产量,多施用高效化肥、农药 |
下列叙述中,能确定某物质一定是酸的是( )
| A、溶液的pH值小于7 |
| B、能使紫色的石蕊试液变红 |
| C、能跟活泼金属反应放出氢气 |
| D、电离出的阳离子全部是氢离子 |
下列说法中正确的是( )
| A、中和反应有盐和水生成,所以有盐和水生成的化学反应一定是中和反应 |
| B、单质只含一种元素,所以含一种元素的物质一定是单质 |
| C、氧化物中含有氧元素,含有氧元素的化合物一定是氧化物 |
| D、溶液是由溶质和溶剂组成,所以溶液一定是混合物 |
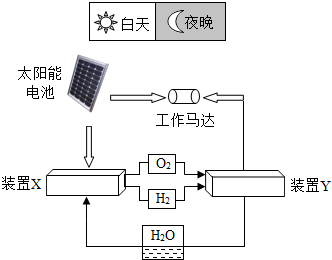 如图是一种航天器能量储存系统原理示意图.下列说法正确的是( )
如图是一种航天器能量储存系统原理示意图.下列说法正确的是( )| A、太阳能电池板的原料是二氧化硅,硅的化合价是+2价 |
| B、装置X中的反应为2H2+O2═2H2O |
| C、装置Y中的反应为2H2+O2═2H2O |
D、氧元素的原子示意图: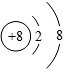 |
以下是某化学反应的微观示意图,图中“ ”与“
”与“ ”分别代表不同原子.下列说法中正确的是( )
”分别代表不同原子.下列说法中正确的是( )

 ”与“
”与“ ”分别代表不同原子.下列说法中正确的是( )
”分别代表不同原子.下列说法中正确的是( )
| A、生成物可能是混合物 |
| B、该反应既不是化合反应也不是分解反应 |
| C、化学反应前后分子的种类可能不变 |
| D、化学反应前后原子的种类不变 |
自来水厂净化水的过程中,一定发生化学变化的是( )
| A、消毒 | B、过滤 | C、吸附 | D、沉降 |