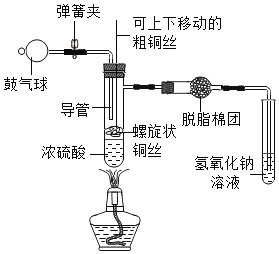
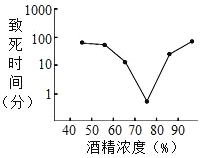
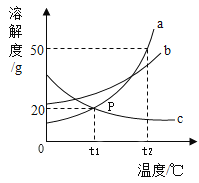
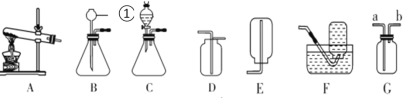
题目内容
【题目】实验室有碳酸钙与碳酸钡的混合物共26.2g,与200g7.3%的盐酸恰好完全反应后得到溶液,又将溶液蒸干得到固体物质,则所得固体物质中金属元素的质量分数为( )
A.50%
B.20%
C.25%
D.30%
【答案】A
【解析】
碳酸钙与碳酸钡混合固体与稀盐酸反应产生氯化钡和氯化钙溶液,蒸干得到固体物质为氯化钡和氯化钙,由氯元素守恒可知:稀盐酸中的氯原子与蒸干后混合固体中的氯元素质量相等,则稀盐酸中氯元素的质量=200g×7.3%×![]() ,稀盐酸中水的质量为200g-200g×7.3%=185.4g;
,稀盐酸中水的质量为200g-200g×7.3%=185.4g;
由稀盐酸与二氧化碳的质量关系,
设产生二氧化碳的质量为m,产生水的质量为n
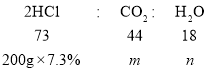
![]()
m=8.8g;
![]()
n=3.6g
蒸干后混合固体质量=26.2g+200g-185.4g-8.8g-3.6g=28.4g
则所得固体物质中金属元素的质量=28.4g-14.2g=14.2g;
所得固体物质中金属元素的质量分数为=![]() ;
;
故选:A。

练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案
相关题目