题目内容
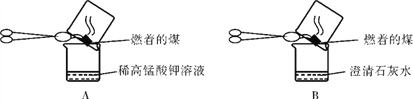
【题目】用下图所示的装置探究“燃烧的条件”及“灭火的原理”。
已知:白磷的着火点为40℃,红磷的着火点为240℃。

(1)实验甲:用可燃物红磷和白磷进行探究,若要证明可燃物燃烧需要与氧气接触,则固体A为_______。
(2)实验乙:将长短两只蜡烛固定在烧杯中,点燃。
①向烧杯中放入干冰后,长蜡烛继续燃烧,短蜡烛的火焰逐渐变小至熄灭。短蜡烛熄灭的原因是_______________。
②向烧杯中继续加入干冰,长蜡烛仍然不熄灭。这一现象反映出CO2具有的性质是___________________。
【答案】 白磷 隔绝了空气(或干冰升华吸热,温度降低到石蜡的着火点以下) 密度比空气大
【解析】(1)根据控制变量法,水中的物质是白磷;
(2)①干冰升华二氧化碳气体使蜡烛隔绝了氧气,故下面的两种熄灭;
②该实验说明二氧化碳的密度比空气的密度大;

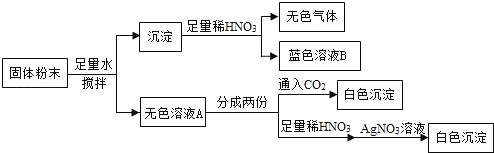
【题目】“低钠盐”可以控制钠的摄入量从而防治高血压等疾病。制备“低钠盐”是在食盐中用NaCl按照配方比例添加食用KCl。国内某些生产厂家为改变“低钠盐”口味还会加入少量镁盐(仅限MgSO4或MgCl2)。
(1)测得某“低钠盐”样品a中只含有NaCl和KCl,该样品中的NaCl和KCl溶于
水时解离出的阴离子都是___________(填离子符号)。
(2)探究某“低钠盐”样品b中是否添加有镁盐,以及添加的是何种镁盐?
【猜想】I、不含镁盐 Ⅱ、含有硫酸镁 Ⅲ、含有氯化镁

【进行实验】
(3)请完成下表(已知BaSO4是难溶于水和酸的白色固体):
假设和现象 | 判断和化学方程式 | |
① | 若现象a为白色沉淀 | 则猜想____不成立。 |
② | 若现象a为_________, 现象b为_________。 | 则猜想Ⅲ成立。写出无色溶液B与硝酸中和反 应的化学方程式_________________。 |
③ | 若现象a、b均 为:产生白色沉淀 | 则猜想____成立。写出无色溶液B与硝酸钡溶液 反应的化学方程式______________。 |
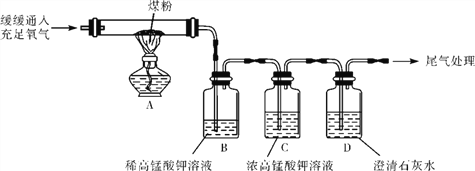
【题目】如图表示治理汽车尾气所涉及反应的微观过程.下列说法正确的是( )
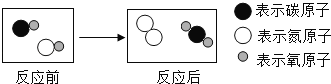
A.图中有两种单质和两种氧化物
B.反应物和生成物均含有毒气体
C.生成单质与化合物的质量比为7:22
D.生成物的分子个数比为1:1
【题目】通过对常见的酸和碱性质的学习,我们知道了酸能与某些金属单质发生反应,但并未提及碱溶液与单质的反应,实际上碱溶液也能与某些非金属单质反应,如氢氧化钠溶液能与氯气发生如下反应:
①![]()
②![]()
某化学兴趣小组的同学在实验室的实验台上发现上一组的同学做完氯气与氢氧化钠溶液的反应后残液未倒掉,遂对该残液的成分进行猜想和实验验证。请你与他们一起完成探究过程。
【猜想】除水外(1)可能含 NaClO和NaCl
(2)可能含 NaClO、NaCl和NaOH
(3)可能含NaClO3、NaCl
你认为还可能是______________________.
【查阅资料】
(1)次氯酸钠(NaClO)溶液呈碱性;有强氧化性,可使淀粉碘化钾试纸变蓝;不稳定,在光照或加热条件下均能分解:2NaClO![]() 2NaCl+O2↑;3 NaClO
2NaCl+O2↑;3 NaClO![]() NaClO3+2NaCl
NaClO3+2NaCl
(2)氯酸钠溶液呈中性。
【实验验证】
实验步骤 | 现象 | 结论 |
(1)取残液滴在淀粉碘化钾试纸上 | 试纸变蓝 | _______________ |
(2)取残液于试管中,加热一段时间,冷却后___________ | 试纸不再变蓝 | ________________ |
(3)________________ | _____________ | 猜想2正确 |
【反思交流】对反应后溶液中溶质的确定,除考虑生成物外还应考虑_____________