题目内容
【题目】某兴趣小组需要配制100g质量分数为9.8%的稀硫酸,假设常温下该稀硫酸的PH值为0.在装有100g该稀硫酸的烧杯中加入104.4gNa2CO3溶液,恰好完全反应,溶液呈中性.
(1)实验室只有98%的浓硫酸,密度为1.84g/cm3.需要量取 mL(保留一位小数)浓硫酸进行稀释;稀释浓硫酸的方法是 .
(2)在如图中,画出烧杯内溶液的PH值变化图象.(标出Na2CO3溶液的质量)
(3)计算所得溶液的溶质质量分数是多少?(写出计算过程)
【答案】 (1)5.4;将浓硫酸沿烧杯壁缓缓注入水中,并且用玻璃棒不断搅拌.(2)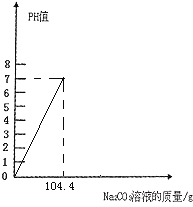 (3)7.1%
(3)7.1%
【解析】
试题分析:(1)设需要浓硫酸的体积为x,
则有:x×1.84g/cm3×98%=100g×9.8%,
x=5.4mL,
稀释浓硫酸的方法是:将浓硫酸沿烧杯壁缓缓注入水中,并且用玻璃棒不断搅拌.
(2)加入104.4gNa2CO3溶液,恰好完全反应,此时溶液的pH=7,如下图所示:

(3)设生成硫酸钠的质量为y,生成二氧化碳的质量为z,
Na2CO3+H2SO4═Na2SO4+H2O+CO2↑,
98 142 44
100g×9.8% y z
![]() =
=![]() =
=![]() ,
,
y=14.2g,z=4.4g,
所得溶液的溶质质量分数为:![]() ×100%=7.1%,
×100%=7.1%,
答:所得溶液的溶质质量分数为7.1%.

练习册系列答案
相关题目




