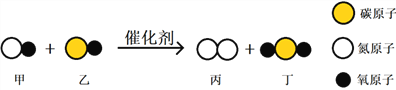
题目内容
【题目】为测定石灰石样品中碳酸钙的质量分数,某校学生进行了如下探究。取12g该样品放入烧杯中,逐滴加入150g稀盐酸(石灰石中的杂质不溶于水,也不反应),并绘制了加入稀盐酸的质量与放出气体的坐标图,如下图所示。计算当恰好完全反应时:
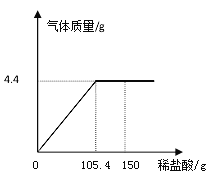
⑴ 产生气体的质量是________g。
⑵ 石灰石样品中碳酸钙的质量分数是__________?(结果保留一位小数)
⑶ 所得溶液中的溶质质量分数是__________?
【答案】 4.4 83.3% 10%
【解析】解:(1)据图象可知:该样品最多与盐酸反应生成二氧化碳4.4g;(2)图象的转折点是二者恰好反应的点,观察图象可知此时用去稀盐酸的质量为105.4g;
设碳酸钙的质量为x,生成的氯化钙质量为y
CaCO3+2HCl═CaCl2+ H2O + CO2↑
100 111 44
xy4.4g
100/x=44/4.4g x=10g
111/y=44/4.4g y=11.1g
该石灰石样品中碳酸钙的质量分数=10g÷12g×100%≈88.3%
(3)反应后氯化钙溶液的质量为:105.4g+10g-4.4g=11.1g
所得溶液中溶质质量分数是:
11.1g÷111g×100%=10%
答:(1)4.4;(2)83.3% ;(3)所得溶液中溶质的质量分数为10%。

 华东师大版一课一练系列答案
华东师大版一课一练系列答案 孟建平名校考卷系列答案
孟建平名校考卷系列答案【题目】下列关于化学实验的“目的——操作——现象——结论”的描述正确的是( )
选项 | 实验目的 | 实验操作 | 实现现象 | 实验结论 |
A | 检验稀盐酸和氢氧化钠溶液是否恰好完全反应 | 在反应后的溶液中滴加无色酚酞试液 | 无明显现象 | 恰好完全反应 |
B | 检验某气体是否是CO2气体 | 将气体通入紫色石蕊溶液中 | 溶液变红 | 原气体一定是CO2 |
C | 鉴别海水和蒸馏水 | 蒸发结晶 | 液体消失,无残留物 | 该液体为蒸馏水 |
D | 检查装置的气密性 |
| 两端液面相平 | 气密性良好 |
A. A B. B C. C D. D