题目内容
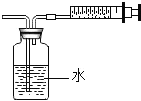
【题目】某同学设计了测定空气中氧气含量的实验,实验装置如图.该同学的实验步骤如下:
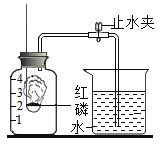
①将图中的集气瓶分为5等份,并作好标记.
② 在带橡皮塞和导管的燃烧匙内装入足量的红磷,将导管上的止水夹夹紧,在酒精灯上点燃红磷,并立即伸入集气瓶内,塞紧橡皮塞.
③ 充分反应后,待集气瓶冷却至室温,打开止水夹.
请回答下列问题:
(1)该实验中红磷需稍过量,目的是___________;红磷燃烧的文字表达式为___________ 。
(2)步骤③中打开止水夹后观察到的现象是______,由此可得出空气中氧气的体积分数约为______。
(3)该实验还可推论出氮气________(选填“易”或“难”)溶于水和其化学性质_______(选填“活泼”或“不活泼”)的结论。
(4)该实验中进入集气瓶中水的体积小于集气瓶中空气体积五分之一的原因有哪些?_____(写一条即可)
【答案】确保集气瓶内的氧气消耗完 磷+氧气![]() 五氧化二磷 烧杯中的水倒流至集气瓶,且进入水的体积约占瓶中空气的1/5 五分之一 难 不活泼 红磷量不足、装置漏气、未等到冷却就打开弹簧夹(答任一即可)
五氧化二磷 烧杯中的水倒流至集气瓶,且进入水的体积约占瓶中空气的1/5 五分之一 难 不活泼 红磷量不足、装置漏气、未等到冷却就打开弹簧夹(答任一即可)
【解析】
实验的目的是测定空气中氧气含量,原理是消耗氧气使装置内外产生压强差,水被吸入占据氧气的空间,从而达到测定氧气的目的.
(1)红磷过量,可使集气瓶中的氧气完全消耗,只有这样才能测出空气中氧气的体积分数,红磷燃烧生成五氧化二磷,反应的文字表达式是:红磷+氧气![]() 五氧化二磷;
五氧化二磷;
(2)由于红磷消耗了空气中的氧气使集气瓶内的压强减小,打开止水夹后观察到的现象是:水沿导管倒流进入集气瓶中,倒流至集气瓶容积的1/5处,由此可得出空气中氧气的体积分数约为1/5;
(3)在该实验中,剩余的气体主要是氮气,说明氮气不能燃烧,也不能支持燃烧,不溶于水等;
(4)该实验中进入集气瓶中水的体积小于集气瓶中空气体积五分之一的原因可能有:红磷不足、装置漏气等;
故答案为:(1)将集气瓶内的氧气全部消耗掉,红磷+氧气![]() 五氧化二磷;(2)烧杯中的水进入集气瓶,约占集气瓶体的1/5,1/5;(3)难,不活泼;(4)红磷不足等.
五氧化二磷;(2)烧杯中的水进入集气瓶,约占集气瓶体的1/5,1/5;(3)难,不活泼;(4)红磷不足等.

 中考解读考点精练系列答案
中考解读考点精练系列答案 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案【题目】下列实验方案设计不能达到对应实验目的的是( )
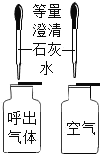
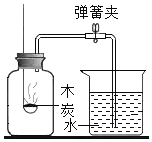
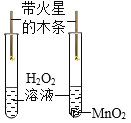
实验目的 | A检查装置的气密性 | B比较空气与人体呼出的气体中CO2含量 | C测定空气中氧气的含量 | D探究MnO2能否加快H2O2分解 |
实验方案 |
|
|
|
|
A. AB. BC. CD. D