题目内容
【题目】(1)用化学符号表示:①1镁原子 ;②2个硝酸根离子 ;
③热水瓶内胆的镀的金属 ;④ 氧化铝中铝元素的化合价为+3价 。
(2)氧是地壳中含量最多的元素,氧及其化合物是化学学习和研究的重要内容。
①从如图氧原子结构示意图中获得的信息,正确的是 (填标号)。
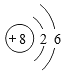
a.![]() 表示原子核,带8个单位正电荷
表示原子核,带8个单位正电荷
B.氧原子核外有2个电子层,有8个电子在核外作高速运动
C.氧原子在化学反应中易失去电子形成氧离子(O2-)
②构成氧气的微粒是 (填符号),氧气经降温和加压变为液态氧后体积变小,这是因为 (用微粒的观点解释)。
③水是重要的氧化物,电解水的化学方程式为 ;登山和潜水供氧装置中,过氧化钠(Na2O2)与水反应,生成氢氧化钠和氧气,有关反应的化学方程式为 。
(3)科学研究表明:同一种元素的原子中其质子数都相同,但中子数却不一定相同。碳元素中就有三种这样的原子,质子数.中子数分别为6.6;6.7;6.8,分别记作为C-12.C-13.C-14原子。①C-12与C-13的化学性质 (填“相同”或“不相同”);
②如果C-14与O原子结合成CO2,则这种CO2的相对分子质量是_________。
【答案】(1)① Mg ② NO3- ;③ Ag;④![]()
(2)①a②O2;分子之间有间隔③2H2O![]() 2H2↑+O2↑;
2H2↑+O2↑;
2Na2O2+2H2O=4NaOH+O2↑(3)①相同②46
【解析】
试题分析:学会正确的表示一些微粒,会表示离子的化合价的不同;构成氧气的微粒是O2,氧气经降温和加压变为液态氧后体积变小,这是因为分子之间有间隔。水是重要的氧化物,电解水的化学方程式为2H2O![]() 2H2↑+O2↑;登山和潜水供氧装置中,过氧化钠(Na2O2)与水反应,生成氢氧化钠和氧气,有关反应的化学方程式为2Na2O2+2H2O = 4NaOH + O2↑;①C-12与C-13的化学性质相同,因为核外电子数相同;如果C-14与O原子结合成CO2,则这种CO2的相对分子质量是=14+32=46.
2H2↑+O2↑;登山和潜水供氧装置中,过氧化钠(Na2O2)与水反应,生成氢氧化钠和氧气,有关反应的化学方程式为2Na2O2+2H2O = 4NaOH + O2↑;①C-12与C-13的化学性质相同,因为核外电子数相同;如果C-14与O原子结合成CO2,则这种CO2的相对分子质量是=14+32=46.