题目内容
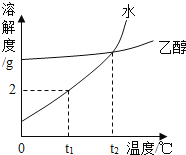
【题目】下图是甲、乙、丙三种物质的溶解度曲线。

(1)t2℃时,甲的溶解度为______
(2)t3℃时,甲、乙各50g,分别加入到100g水中,充分搅拌。其中,不能形成饱和溶液的是_____
(3)t3℃时,甲的饱和溶液中含有少量的丙,现要提纯甲可采用的方法是______________
(4)下列说法正确的是_________
A.将甲、乙的饱和溶液分别从t1℃升温到t2℃,溶质的质量分数都不变
B.t2℃时,向100g20%甲的饱和溶液中加100g水,充分搅拌,溶液的浓度为10%
C.t3℃时,等质量的甲、乙、丙分别制成饱和溶液,需水的质量最多的是甲
D.升高丙溶液的温度,一定有晶体析出
【答案】(1)25g
(2)甲
(3)降温结晶
(4)AB
【解析】(1)根据溶解度曲线图的意义可知,t2℃时,甲的溶解度为25g。
(2)t3℃时,甲的溶解度大于50g;乙的溶解度小于50g。t3℃甲50g加入到100g水中,充分搅拌,形成的溶液还可以继续溶解甲,即得到的是甲的不饱和溶液;t3℃乙50g加入到100g水中,充分搅拌,乙无法完全溶解,即形成的溶液不能继续溶解乙,所以得到的是乙的饱和溶液。
(3)t3℃时,甲的饱和溶液中含有少量的丙,可对溶解进行降温。由于甲的溶解度会随着温度的降低而减小,所以会析出甲;丙的溶解度随着温度的降低而升高,则不会析出丙。则可达到提纯甲的目的。
(4)A、t1℃升温到t2℃,甲乙的溶解度都会变大,则溶液的组成不会变化,所以溶质质量分数均不会变化。此项正确。B、t2℃时,向100g20%甲的饱和溶液中加100g水,则溶液中溶质质量分数为:![]() ×100%=10% 此项正确。C、t3℃时,甲、乙、丙的溶解度甲最大,其次是乙,丙最小。所以等质量的三物质分别制成饱和溶液,需水的质量由多到少的顺序为丙、乙、甲。此项错误。D、升高丙溶液的温度,则丙的溶解度会变小。但如原溶解不饱和则可能不会有晶体析出。此项错误。
×100%=10% 此项正确。C、t3℃时,甲、乙、丙的溶解度甲最大,其次是乙,丙最小。所以等质量的三物质分别制成饱和溶液,需水的质量由多到少的顺序为丙、乙、甲。此项错误。D、升高丙溶液的温度,则丙的溶解度会变小。但如原溶解不饱和则可能不会有晶体析出。此项错误。

 名校课堂系列答案
名校课堂系列答案