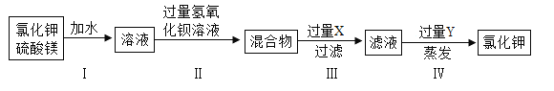
题目内容
高纯MnCO3是制备电信器材高性能磁性材料的主要原料。实验室以MnO2为原料制备少量高纯MnCO3的操作步骤如下:
[查阅资料]
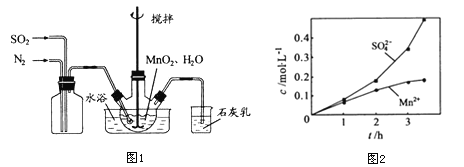
①向烧瓶中(见图1)通入过量混合气进行“浸锰”操作,主要反应原理为: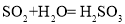 ;
; 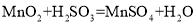
②向“浸锰”结束后的烧瓶中加入一定量纯MnO2粉末。
③用Na2CO3溶液调节pH为3.5左右,过滤。
④调节滤液pH为6. 5~7.2,加入NH4HCO3,观察到有少量气体生成,有浅红色的沉淀生成,过滤、洗涤、干燥,得到高纯碳酸锰。
⑤H2SO3和O2在催化剂的催化作用下生成H2SO4。
[实验探究]
(1)①图1中应该先通入________一段时间后再通入___,原因是_____,石灰乳的作用是_____(用化学方程式表示)。
②若实验中将N2换成空气,测得反应液中Mn2+、SO42-的浓度随反应时间t变化如图2所示,导致溶液中Mn2+、SO42-浓度变化产生明显差异的原因是_______,此时Mn2+的作用是_______。
③反应过程中,为使SO2尽可能转化完全,在通入SO2和N2比例一定、不改变固液投料的条件下,可采取的合理措施是____(写出一 条即可)。
(2)加入的NH4HCO3与MnSO4溶液发生反应,请写出其化学方程式________。
练习册系列答案
相关题目


 氯化钠的取用
氯化钠的取用 氯化钠的称量
氯化钠的称量 水的取用
水的取用 氯化钠的溶解
氯化钠的溶解