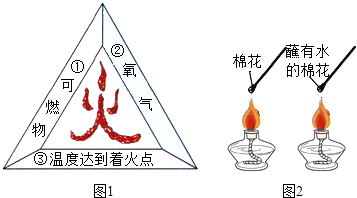
题目内容
【题目】金属及金属材料和我们密切相关。
I、世界上最常见、应用很广泛的合金材料是_______和_________。
II、将镁铝合金与铝片相互刻划,在铝片表面留下了明显划痕,说明镁铝合金的硬度______铝的硬度(填“大于”或“小于”)。
III、许多金属与酸反应都能生成氢气。
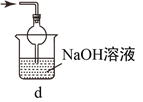
(1)仪器的名称 a__________________ b______________________
(2)适合于实验室制取氢气的发生装置是__________(填序号,下同),收集装置是___________
(3)请写出一个用于实验室制备氢气的化学反应方程式___________________________
IV、黄铜(铜锌合金)是我们生活中一种常见的金属材料,常被用于制造阀门、水管、空调内外机连接管和散热器等。
(1)黄铜外观和黄金很像,下列方法不可用于区分黄铜和黄金的是________(填序号)
A.比硬度 B.灼烧 C.用磁铁吸引 D.放入稀盐酸中
(2)为了测定某黄铜样品中铜的质量分数,取10g该黄铜样品加入到稀硫酸中,恰好完全反应,产生氢气0.1g。该黄铜样品中铜的质量分数为________(计算结果保留一位小数)
【答案】 钢 生铁 大于 长颈漏斗 集气瓶 B或C D或F Zn+H2SO4═ZnSO4+H2↑ C 【答题空10】67.5%
【解析】I、世界上最常见、应用很广泛的合金材料是钢和生铁;
II、将镁铝合金与铝片相互刻划,在铝片表面留下了明显划痕,说明镁铝合金的硬度大于铝的硬度;
III、(1)仪器a是长颈漏斗;仪器b是集气瓶;
(2)实验室用金属锌与稀硫酸反应制取氢气不需要加热,应该用B或C装置作为发生装置;氢气不溶于水,可以用排水法收集,即用D装置收集,密度比空气小,可以用向下排空气法收集,即用F装置收集;
(3)锌与稀硫酸生成硫酸锌和氢气,化学方程式为:Zn+H2SO4═ZnSO4+H2↑;
IV、(1)A、合金的硬度大于纯金属,所以相互刻划,比较硬度的方法可以区分,正确;B、灼烧时铜能与氧气反应所以灼烧时能变黑色的是假黄金,不变色的是真黄金,正确;C、黄铜和黄金都不会被磁铁吸引,错误;D、金不会与酸反应,而锌能与酸反应生成氢气,所以加酸时能生成气体的是假黄金,没有现象的是真黄金,正确。故选C。
(2)解:设锌的质量为x
Zn+H2SO4═ZnSO4+H2↑
65 2
x 0.1g
![]()
x=3.25g
黄铜样品中铜的质量分数为![]() ×100%=67.5%。
×100%=67.5%。
答:黄铜样品中铜的质量分数为67.5%。

 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案【题目】某化学兴趣小组进行了实验室模拟炼铁。
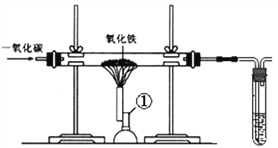
【实验步骤】
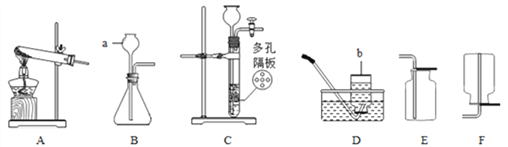
(1)组装仪器,并_______________________________。
(2)装入药品后,先通入一氧化碳,待排尽装置内空气后,再点燃 _________________(填仪器①的名称)。
(3)当______________________时,停止加热。
(4)待玻璃管内物质冷却后,___________________________。
【分析与讨论】小王同学认为该黑色固体全部是铁,但小李同学提出了质疑,于是大家提出查阅资料。
【查阅资料】①CO还原Fe2O3的固体产物的成分与反应温度、反应时间等因素有关;Fe2O3与CO反应的固体生成物与温度的关系:
![]()
②相关物质的一些性质
物质性质 | 四氧化三铁 | 氧化亚铁 | 氧化铁 | 铁粉 |
颜色 | 黑色 | 黑色 | 红色 | 黑色 |
能否被磁铁吸引 | 能 | 不能 | 不能 | 能 |
【实验与猜想】
(1)于是该小组同学将反应后的黑色固体,用磁铁吸引,发现黑色固体粉末能全部被吸引。因此可推断黑色固体粉末中不可能含有氧化铁和______________。
(2)为进一步确定黑色固体的成分,小组同学进行了定量测定。按实验设计,测得下列数据:
①反应前玻璃管和内盛氧化铁粉末的总质量64.80g(玻璃管的质量为60.0g)
②反应后玻璃管和内盛黑色固体的总质量63.68g(冷却到室温称量)
通过实验中获得的数据进行计算,可得出黑色固体粉末的成分及质量分数为______________________。
【反思与评价】
(1)小组同学经过讨论认为,一氧化碳还原氧化铁时,若要得到较纯的铁,应该__________(填序号)。
①可适当提高反应温度 ②适当延长加热时间 ③固体要粉碎
(2)上述装置有一明显缺陷,请加以改正______________________________。
【实践应用】
某钢铁公司用480万吨含氧化铁60%的赤铁矿石炼铁,请问能得到含杂质5%的生铁_____________万吨?(要有计算过程,结果保留一位小数)