题目内容
(2008?高淳县一模)环境保护是一个全球性的话题,作为对世界影响力最大的体育盛会--奥林匹克运动会,长期以来,在环保方面给世人留下的似乎是麻烦.2008年奥运,我国承诺“绿色奥运”.本次奥运会环保标志由人与绿树为主要形态.绿色的线条形如舞动的彩带,环绕交错,一笔描出,仿佛茂密的树冠,又似盛开的花朵,充满无限生机和希望,充分体现了自然环保的可持续性发展.树冠与人组成参天大树,代表着人与自然的和谐统一.我们在初中化学学习的过程中接触了许多与环境保护有关的知识.
(一)空气污染与保护
(Ⅰ)二氧化碳是大气中的主要温室气体,我国二氧化碳的排放量位居世界第二.为减少空气中二氧化碳这种温室气体,我们可以采取的措施有(只填2种):______,______.
(Ⅱ)为减缓二氧化碳使全球变暖的趋势,有科学家提出大胆设想:将排放到空气中的二氧化碳压缩使其液化,然后将其压入到冰冷的深海中.但也有科学家担心海水中富含二氧化碳后酸度会增加,可能会杀死一些海洋生物,甚至会溶解掉部分海床,同时气候变化也可能改变海洋环流,把海底的二氧化碳又带回海面,另外把二氧化碳压入海底所消耗的能源可能会再增加二氧化碳的排放.
(1)实现二氧化碳液化,压缩过程将会______能量(填“释放”或“消耗”);
(2)二氧化碳使海水酸度增加的原理用化学方程式表示为:______;
(3)二氧化碳在深海中的溶解度______(填“大于”、“小于”或“等于”)在通常状况下的水中的溶解度,原因是______.
(二)水污染与保护
近几年我国不少水域多次发生“赤潮”、“水华”现象,这是水中的藻类生长繁殖过快导致的水质恶化现象.
(Ⅰ)河水的微生物使有机物(假设以C6H10O5表示)转化成二氧化碳和水的过程所需氧气的量叫生化需氧量(简称BOD),BOD是衡量水体质量的一个指标.写出C6H10O5和氧气反应的化学方程式______.
(Ⅱ)某化学兴趣小组在课外活动中,对某工厂排放出的无色废水进行了多次检测,其中三次检测结果如下表所示,请回答:
| 检测次数 | 废液中检测出的物质 |
| 第一次 | KNO3、Ba(NO3)2、Cu(NO3)2、HNO3 |
| 第二次 | KNO3、Ba(NO3)2、Mg(NO3)2、HNO3 |
| 第三次 | KNO3、Ba(NO3)2、AgNO3、HNO3 |
(2)在检测时,为了确定该工厂排放的废液中到底是否含有Mg2+、Ag+,该兴趣小组的同学作了进一步检验:取样,向其中加入______溶液,发现没有明显现象,说明溶液中没有Ag+,第三次检测结果是不正确的.
(3)加入适量的KOH,可以将废液中的Mg(NO3)2、HNO3除去,再加入适量的草木灰提取物(主要成分为碳酸钾,其余成分不参与反应),可以将废液中的Ba(NO3)2除去,并得到一种复合肥料,该复合肥料为______.
(4)为了防止废液中的钡离子污染环境,该兴趣小组提出了用草木灰提取物处理废水后再排放的建议.他们通过测定得知,该工厂排放出来的废水中Ba(NO3)2的质量分数为2.61%,已知该厂每天排放的废水为100吨,请通过计算确定每天需要多少吨K2CO3含量为30%的草木灰提取物,才能将废水中的钡离子除去?

【答案】分析:(一)(I)首先要了解如何减少二氧化碳气体的排;
(II)了解影响气体溶解度的因素以及碳酸的形成.
(二)(I)其此了解反应物和生成物的基础上书写反应式.
(II)(1)根据颜色判断
(2)知道Ag+与哪些离子可生成沉淀.
(3)了解碳酸钾与Ba(NO3)2的反应原理.
(4)首先计算出100吨废液中含Ba(NO3)2的量,在书写对化学反应,最后计算出K2CO3含量为30%的草木灰是多少.
解答:解:(一)(Ⅰ)大气中的二氧化碳主要来自化石燃料的大量使用,要想减少二氧化碳的排放,首先要减少化石燃料的燃烧;植物的光合作用可以吸收空气中的二氧化碳,所以植树造林是减少空气中二氧化碳含量的好方法.
故答案为:多植树造林;减少化石燃料的燃烧.
(Ⅱ)(1、实现二氧化碳液化,压缩过程将会消耗能量.故答案:消耗
(2)二氧化碳溶于水后会生成碳酸,反应式:CO2+H2O═H2CO3
(3)因为深海中压强大、温度低,气体的溶解度增大,二氧化碳在深海中的溶解度大于大于通常状况下的水中的溶解度.
故答案:大于、深海中压强大、温度低,气体的溶解度增大
(二)(Ⅰ)了解了反应物和生成物,根据质量守恒定律,方程式如下:C6H10O5+6O2═6CO2+5H2O
(Ⅱ)(1)因硝酸铜溶液是蓝色的,而工厂排放出的是无色废水,通过观察可知第一次检测结果不正确.
故答案:一
(2)如果废液中有AgNO3,当加入含氯元素的溶液后,其中的Ag+会与Cl-反应生成不溶于水的AgCl沉淀,而检验时发现没有明显现象,说明溶液中没有Ag+.所以可用氯化钠(或氯化钾)等检验.
故答案:氯化钠(或氯化钾)
(3)据题意可知草木灰的主要成分是碳酸钾,碳酸钾可以与废液中的Ba(NO3)2反应,生成碳酸钡沉淀,除去Ba(NO3)2,并生成硝酸钾(或KNO3),硝酸钾是一种化学肥料,因含有K和N,叫做复合肥料.
故答案:硝酸钾(或KNO3)
(4)废水中Ba(NO3)2的质量分数为2.61%,100吨废液中含Ba(NO3)2:100×2.61%=2.16t
解:设所需K2CO3的质量为X
Ba(NO3)2+K2CO3=BaCO3↓+2KNO3
216 138
2.16 X
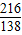 =
=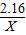
X=1.38t
因草木灰中K2CO3含量为30%,故1.38tK2CO3需草木灰:1.38÷30%=4.6t
答:每天需要4.6t吨K2CO3含量为30%的草木灰提取物,才能将废水中的钡离子除去.
点评:本题以二氧化碳为切入点,即考查了二氧化碳对环境的影响,又考查物质的鉴别,除杂的方法,化学式的有关计算.培养学生的总和化学能力.
(II)了解影响气体溶解度的因素以及碳酸的形成.
(二)(I)其此了解反应物和生成物的基础上书写反应式.
(II)(1)根据颜色判断
(2)知道Ag+与哪些离子可生成沉淀.
(3)了解碳酸钾与Ba(NO3)2的反应原理.
(4)首先计算出100吨废液中含Ba(NO3)2的量,在书写对化学反应,最后计算出K2CO3含量为30%的草木灰是多少.
解答:解:(一)(Ⅰ)大气中的二氧化碳主要来自化石燃料的大量使用,要想减少二氧化碳的排放,首先要减少化石燃料的燃烧;植物的光合作用可以吸收空气中的二氧化碳,所以植树造林是减少空气中二氧化碳含量的好方法.
故答案为:多植树造林;减少化石燃料的燃烧.
(Ⅱ)(1、实现二氧化碳液化,压缩过程将会消耗能量.故答案:消耗
(2)二氧化碳溶于水后会生成碳酸,反应式:CO2+H2O═H2CO3
(3)因为深海中压强大、温度低,气体的溶解度增大,二氧化碳在深海中的溶解度大于大于通常状况下的水中的溶解度.
故答案:大于、深海中压强大、温度低,气体的溶解度增大
(二)(Ⅰ)了解了反应物和生成物,根据质量守恒定律,方程式如下:C6H10O5+6O2═6CO2+5H2O
(Ⅱ)(1)因硝酸铜溶液是蓝色的,而工厂排放出的是无色废水,通过观察可知第一次检测结果不正确.
故答案:一
(2)如果废液中有AgNO3,当加入含氯元素的溶液后,其中的Ag+会与Cl-反应生成不溶于水的AgCl沉淀,而检验时发现没有明显现象,说明溶液中没有Ag+.所以可用氯化钠(或氯化钾)等检验.
故答案:氯化钠(或氯化钾)
(3)据题意可知草木灰的主要成分是碳酸钾,碳酸钾可以与废液中的Ba(NO3)2反应,生成碳酸钡沉淀,除去Ba(NO3)2,并生成硝酸钾(或KNO3),硝酸钾是一种化学肥料,因含有K和N,叫做复合肥料.
故答案:硝酸钾(或KNO3)
(4)废水中Ba(NO3)2的质量分数为2.61%,100吨废液中含Ba(NO3)2:100×2.61%=2.16t
解:设所需K2CO3的质量为X
Ba(NO3)2+K2CO3=BaCO3↓+2KNO3
216 138
2.16 X
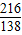 =
=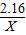
X=1.38t
因草木灰中K2CO3含量为30%,故1.38tK2CO3需草木灰:1.38÷30%=4.6t
答:每天需要4.6t吨K2CO3含量为30%的草木灰提取物,才能将废水中的钡离子除去.
点评:本题以二氧化碳为切入点,即考查了二氧化碳对环境的影响,又考查物质的鉴别,除杂的方法,化学式的有关计算.培养学生的总和化学能力.

练习册系列答案
相关题目


 Na2SO4+2HCl↑,该反应所属的基本反应类型是( )
Na2SO4+2HCl↑,该反应所属的基本反应类型是( )