题目内容
结合如图所示实验,回答下列问题:
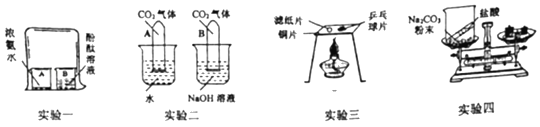
(1)实验一中,B中酚酞溶液变为红色,实验的目的_____。
(2)实验二中,观察到_____现象,说明氢氧化钠溶液和二氧化碳发生了反应;
(3)实验三,验证可燃物燃烧需要的条件是_____。
(4)用实验四探究质量守恒定律,没有得出正确结论,改进的方法是_____。
 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案某校研究小组对氯酸钾热分解进行以下探究。
[探究一]第一小组通过氧气传感器进行探究,绘制出氧气浓度随温度的变化如图所示。
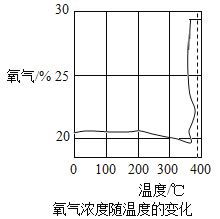
查阅资料:KClO3的熔点约为356°C,MnO2的分解温度约为535°C,用酒精灯给物质加热,受热物质的温度一般约为400°C左右,从图中可知,KClO3分解温度_____(填“>”、“=”或“<”)其熔点。在KCIO3分解前,传感器得到氧气浓度降低的可能原因是____。
[探究二]第二小组发现:氯酸钾与氧化铜混合加热,也能较快产生氧气。于是,按下表进行实验探究,并测定分解温度。
实验编号 | 实验用品 | 分解温度 |
① | 3.0g氯酸钾 | 580 |
② | 3.0g氯酸钾和1.0g二氧化锰 | 350 |
③ | xg氯酸钾和1.0g氧化铜 | 370 |
(1)实验3中x的值应为_____;由对比实验____(填标号),证明氧化铜也会加快氯酸钾的分解,但催化效果更好的物质是_____。
(2)在探究“氧化铜用量与一定质量氯酸钾分解速率关系”时,得出有关实验数据如下:
氧化铜与氯酸钾的质量比 | 1/40 | 1/20 | 1/10 | 1/5 | 1/3 | 1/2 | 2/3 | 1/1 | 2/1 |
生成1L氧气所需的时间(s) | 124 | 79 | 50 | 54 | 75 | 93 | 106 | 153 | 240 |
分析数据:氧化铜与氯酸钾的质量比为____时,反应速率最快。因此,在化学反应中催化剂的用量_____ (填“是”或“不是”)越多越好。
[探究三]第三小组利用氯酸钾和二氧化锰制取氧气时,发现生成的气体略带颜色,并有刺激性气味。
提出问题:生成的气体中除了氧气外还含有什么物质?
查阅资料:①常温下,氯气是黄绿色、二氧化氯是黄色,都有强烈刺激性气味的气体;
②二氧化氯具有强氧化性,可与硫酸锰溶液反应生成不溶于水的二氧化锰,而氯气不能。
提出假设:
假设1:含有氯气;假设2:含有二氧化氯。
设计实验:
实验步骤 | 实验现象 | 实验结论 |
____ | _____ | 假设2正确 |
为测定含少量氯化钠杂质的纯碱样品中碳酸钠的质量分数。某化学兴趣小组进行如下实验,取5.7g的样品放置于烧杯中,加入30g水全部溶解,向烧杯中滴加一定质量的10%的稀盐酸,恰好完全反应。反应过程用精密仪器测得烧杯和药品的质量与反应时间的数据记录如下:
反应时间/s | 0 | 5 | 10 | 15 | 20 | 25 |
烧杯与药品的质量/g | 207.8 | 207.25 | 206.7 | 206.15 | 205.6 | 205.6 |
通过计算回答:
(1)产生的二氧化碳的质量是多少克_______;
(2)样品中碳酸钠的质量分数_______(结果保留到0.1%,下同);
(3)所得到的溶液中溶质的质量分数_______。


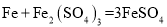 、
、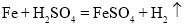 、_________。
、_________。