题目内容
把两种金属的混合物 6g,放入足量的稀硫酸中完全反应,结果得到氢气0.2g,则混合物中所含的物质不可能是
- A.锌和铁
- B.锌和镁
- C.锌和铜
- D.锌和铝
C
分析:利用一定质量金属完全反应放出:氢气质量=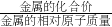 ×金属质量,计算生成1g氢气消耗选项所涉及金属铁、锌、镁、铝的质量;然后根据题设的条件:两种金属混合物10g,与足量稀硫酸反应后生成了l g氢气,推断出两种金属混合物的可能组成.
×金属质量,计算生成1g氢气消耗选项所涉及金属铁、锌、镁、铝的质量;然后根据题设的条件:两种金属混合物10g,与足量稀硫酸反应后生成了l g氢气,推断出两种金属混合物的可能组成.
解答:根据与硫酸反应时铁、锌、镁、铝分别呈+2、+2、+2、+3价,与足量稀硫酸反应后生成了0.2g氢气,所需要消耗金属的质量分别为:
需要金属铁的质量=0.2g÷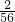 =5.6g;需要金属锌的质量0.2g÷
=5.6g;需要金属锌的质量0.2g÷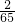 =6.5g;需要金属镁的质量=0.2g÷
=6.5g;需要金属镁的质量=0.2g÷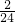 =2.4g;需要金属铝的质量=0.2g÷
=2.4g;需要金属铝的质量=0.2g÷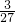 =1.8g;铜不与稀硫酸反应;
=1.8g;铜不与稀硫酸反应;
根据金属混合物与酸反应产生气体质量为两种金属反应产生氢气质量和,由实际实验中两种金属混合物6g与足量稀硫酸反应后生成了0.2g氢气,可判断混合物中两种金属只可能为金属:锌和铁、锌和镁、锌和铝的混合物;而不可能是锌和铜的混合物.
故选C.
点评:一定质量金属完全反应放出:氢气质量=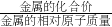 ×金属质量,利用该公式进行计算时,需要注意到铁在与酸发生置换反应时呈现出+2价.
×金属质量,利用该公式进行计算时,需要注意到铁在与酸发生置换反应时呈现出+2价.
分析:利用一定质量金属完全反应放出:氢气质量=
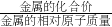 ×金属质量,计算生成1g氢气消耗选项所涉及金属铁、锌、镁、铝的质量;然后根据题设的条件:两种金属混合物10g,与足量稀硫酸反应后生成了l g氢气,推断出两种金属混合物的可能组成.
×金属质量,计算生成1g氢气消耗选项所涉及金属铁、锌、镁、铝的质量;然后根据题设的条件:两种金属混合物10g,与足量稀硫酸反应后生成了l g氢气,推断出两种金属混合物的可能组成.解答:根据与硫酸反应时铁、锌、镁、铝分别呈+2、+2、+2、+3价,与足量稀硫酸反应后生成了0.2g氢气,所需要消耗金属的质量分别为:
需要金属铁的质量=0.2g÷
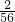 =5.6g;需要金属锌的质量0.2g÷
=5.6g;需要金属锌的质量0.2g÷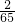 =6.5g;需要金属镁的质量=0.2g÷
=6.5g;需要金属镁的质量=0.2g÷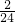 =2.4g;需要金属铝的质量=0.2g÷
=2.4g;需要金属铝的质量=0.2g÷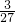 =1.8g;铜不与稀硫酸反应;
=1.8g;铜不与稀硫酸反应;根据金属混合物与酸反应产生气体质量为两种金属反应产生氢气质量和,由实际实验中两种金属混合物6g与足量稀硫酸反应后生成了0.2g氢气,可判断混合物中两种金属只可能为金属:锌和铁、锌和镁、锌和铝的混合物;而不可能是锌和铜的混合物.
故选C.
点评:一定质量金属完全反应放出:氢气质量=
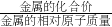 ×金属质量,利用该公式进行计算时,需要注意到铁在与酸发生置换反应时呈现出+2价.
×金属质量,利用该公式进行计算时,需要注意到铁在与酸发生置换反应时呈现出+2价. 
练习册系列答案
相关题目