题目内容
【题目】某化学兴趣小组对金属的性质做了如下探究,请你填写空格:
(1)用下图所示实验探究铁生锈的条件(每支试管中均放有完全相同的洁净铁片):
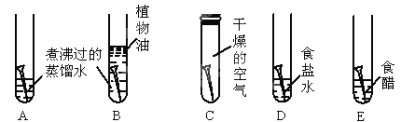
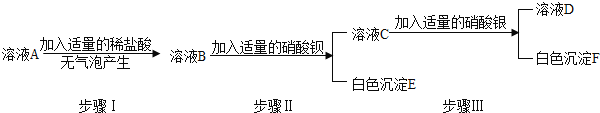
①甲同学认为,试管A发生的现象就能够说明铁的锈蚀是铁与空气中的氧气、水蒸气共同作用的结果。乙同学不同意他的观点,认为必须全面观察试管_____________(选填试管编号)发生的现象,并经过科学严谨的推理,才能得出上述结论。
②试管D和E实验的目的是进一步探究铁在_____________________的环境中是否更容易锈蚀。
③为防止金属锈蚀,除了采用覆盖保护膜等措施以外,还可以制成合金。这是因为合金与纯金属相比,其组成和内部组织结构发生变化,从而引起__________________的变化。
(2)某同学向分别盛有等质量的铁粉和锌粒的试管中,倒入等质量、等溶质质量分数的稀硫酸,以“金属表面产生气泡的快慢”为标准来判断两种金属的活动性强弱。有的同学认为这种方案不够合理,理由是____________________________。
(3)将一定质量的铁粉放入硝酸铜、硝酸锌的混合溶液中,充分反应后过滤,所得固体中一定含有的物质是_______ _______,且反应后溶液质量比反应前___________(选填“增大”、“减小”或“不变”)。
【答案】(1)①ABC ②盐、酸存在 ③性质
(2)没有控制相同的条件 ,金属的表面积不同
(3)铜 减少
【解析】
试题分析:(1)铁生锈的条件是要和水、氧气同时接触,可通过对比实验要确定,即比较试管ABC发生的现象;食盐水属盐溶液,食醋属于酸溶液;物质的组成及结构决定物质的性质;
(2)判断两种金属的活动性强弱,要通过控制变量法来进行实验,即只要金属的种类不同,其他的条件要完全相同。
(3)铁的活动性比铜强,但比锌弱,故只能把铜从溶液中置换出来,根据化学方程式,铁与铜反应的质量比为56:64 ,即反应后溶液质量比反应前减小。

 全优测试卷系列答案
全优测试卷系列答案 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案【题目】【2014年贵州省黔东南州市】学习了CO2的有关知识后,同学们查阅资料发现Mg能在CO2中燃烧:2Mg+CO2═2MgO+C,所以镁着火不能来CO2来灭火,但没有找到有关Na能否与CO2反应的介绍.于是同学们展开了钠着火能否用CO2来灭火的探究.
【提出猜想】钠能发生类似于CO2与镁的反应,可能的化学方程式为 _________ .
【实验】将燃着的钠伸入装有CO2的集气瓶中,钠能在集气瓶中继续燃烧.
进一步【查阅资料】得知:
①Na2O是白色固体,能与CO2反应生成Na2CO3,也能与H2O反应生成NaOH.
②Ba(OH)2溶于而BaCO3不溶于水.
③Na2CO3的存在会干扰NaOH的检测.
基于以上资料,同学们认为钠在CO2中燃烧的产物情况有所不同,并对产物提出了以下几种猜想:
Ⅰ.Na2O、C;Ⅱ _________ 、C;Ⅲ.NaOH、C;Ⅳ.Na2O、Na2CO3、C
通过理论分析,猜想 _________ (填序号)肯定错误的,理由是 _________
【验证猜想】
步骤 | 实验操作 | 主要实验现象 | 结论(燃烧产物判断) |
(1) | 将产物溶于适量水中 | 部分溶解,试管底部有黑色固体 | 燃烧产物中肯定有C |
(2) | 取少量(1)所得上层溶液,加入过量的BaCl2溶液 | _________ | 燃烧产物中肯定有Na2CO3 |
(3) | 取少量(2)所得上层清液,加入 _________ 溶液 | 有蓝色沉淀生成 | 燃烧产物中肯定有 _________ |
在步骤(2)中BaCl2溶液为什么要加入至过量?其原因是: _________ .
【结论】猜想 _________ (填序号)是正确的.