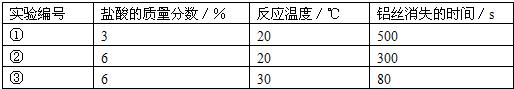
题目内容
.用“>”“=”“<”符号填写下列空白.
(1)将铁棒浸入ag硫酸铜溶液中,反应一会儿取出,溶液质量变为bg,则a______b.
(2)mg KclO3受热完全分解得agO2,mgKMnO4受热完全分解得bgO2,则a______b.
(3)取两份质量分别为ag和bg的锌片,一份与足量衡硫酸反应,另一份与足量盐酸反应,若生成等质量的H2,则a______b.
解:(1)铁能与硫酸铜反应生成硫酸亚铁和铜,
Fe+CuSO4═FeSO4+Cu
56 160 152 64
参加反应的硫酸铜的质量为160,参加反应的硫酸亚铁的质量为152,故溶液的质量减小,故答案为:a>b
(2)2KMnO4 K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
316 32
mg ag

a=
2KClO3 2KCl+3O2↑
2KCl+3O2↑
245 96
mg bg

b=
所以a<b
故答案为:a<b
(3)两份质量分别为ag和bg的锌片,一份与足量衡硫酸反应,另一份与足量盐酸反应,根据质量守恒定律,则可知则生成氢气的质量一样多.故答案为a=b
分析:根据质量守恒定律和反应物及生成物各物质质量比可以判断出同质量的反应物生成生成物的多少.
点评:解答本题要掌握根据化学方程式进行相关方面计算的方法,只有这样才能对问题做出正确的判断.
Fe+CuSO4═FeSO4+Cu
56 160 152 64
参加反应的硫酸铜的质量为160,参加反应的硫酸亚铁的质量为152,故溶液的质量减小,故答案为:a>b
(2)2KMnO4
 K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑316 32
mg ag

a=

2KClO3
 2KCl+3O2↑
2KCl+3O2↑245 96
mg bg

b=

所以a<b
故答案为:a<b
(3)两份质量分别为ag和bg的锌片,一份与足量衡硫酸反应,另一份与足量盐酸反应,根据质量守恒定律,则可知则生成氢气的质量一样多.故答案为a=b
分析:根据质量守恒定律和反应物及生成物各物质质量比可以判断出同质量的反应物生成生成物的多少.
点评:解答本题要掌握根据化学方程式进行相关方面计算的方法,只有这样才能对问题做出正确的判断.

练习册系列答案
 快捷英语周周练系列答案
快捷英语周周练系列答案
相关题目