题目内容
下面是某学习小组对Cu、Fe、Mg、Ag、Al五种金属相关知识的学习与探究。请你参与并回答问题:
⑴ 下列制品中,主要利用金属导电性的是 (填序号,下同)。

A.铁锅 B.铜导线 C.铝箔
⑵ 铝的原子结构示意图为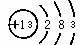 ,该原子在化学反应中易(填“得”或“失”)
,该原子在化学反应中易(填“得”或“失”)
电子。
⑶ 铜和稀硫酸不反应,与浓硫酸在一定条件下可以反应,其化学方程式为:
Cu + 2H2SO4(浓) CuSO4 + X↑ + 2H2O,则X的化学式为 。
CuSO4 + X↑ + 2H2O,则X的化学式为 。
⑷ 所给五种金属分别放入到同一盐酸中,最剧烈的反应的化学方程式为 。
⑸ 向AgNO3和Cu(NO3)2的混合溶液中加入一定量的铁粉,充分反应后过滤,向滤渣中加入稀盐酸,无气泡产生。根据上述现象,能得出的结论是 。
A.滤渣中一定有Fe B.滤渣中一定有Cu
C.滤液中一定有Fe2+ D.滤液中一定有Ag+、Cu 2+
⑴ 下列制品中,主要利用金属导电性的是 (填序号,下同)。

A.铁锅 B.铜导线 C.铝箔
⑵ 铝的原子结构示意图为
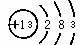 ,该原子在化学反应中易(填“得”或“失”)
,该原子在化学反应中易(填“得”或“失”)电子。
⑶ 铜和稀硫酸不反应,与浓硫酸在一定条件下可以反应,其化学方程式为:
Cu + 2H2SO4(浓)
 CuSO4 + X↑ + 2H2O,则X的化学式为 。
CuSO4 + X↑ + 2H2O,则X的化学式为 。⑷ 所给五种金属分别放入到同一盐酸中,最剧烈的反应的化学方程式为 。
⑸ 向AgNO3和Cu(NO3)2的混合溶液中加入一定量的铁粉,充分反应后过滤,向滤渣中加入稀盐酸,无气泡产生。根据上述现象,能得出的结论是 。
A.滤渣中一定有Fe B.滤渣中一定有Cu
C.滤液中一定有Fe2+ D.滤液中一定有Ag+、Cu 2+
⑴ B ⑵ 失 ⑶ SO2 ⑷ Mg + 2HCl ="=" MgCl2 + H2↑ ⑸ C
:(1)铜导线常用在电器上,主要是利用了其具有导电性的物理性质.
故选B.
(2)核外电子的最外层电子数决定了其物理性质,最外层电子数小于3的原子,化学反应中易失去电子.
故答案为:失.
(3)根据质量守恒定律:在化学反应中,反应前后原子的种类没有改变,数目没有增减,可推断化学方程式为:Cu+2H2SO4(浓) CuSO4+2H2O+X↑ 中X的化学式为SO2.
CuSO4+2H2O+X↑ 中X的化学式为SO2.
故答案为:SO2.
(4)所给五种金属分别放入到同一盐酸中,最剧烈的反应即是化学活动性最强的金属,在五种金属中镁的活动性最强,反应最剧烈.
故答案为:Mg+2HCl═MgCl2 +H2↑.
(5)加入的铁全部发生了反应,则一定有银被置换出来;由于铁粉为一定量,所以无法判断铁粉是否与AgNO3完全反应,也就无法进一步判断是否和混合溶液中的往Cu(NO3)2发生了反应;因此,只能得到滤液中一定含有Fe(NO3)2、滤渣中一定含有Ag的结论.
故选C.
故选B.
(2)核外电子的最外层电子数决定了其物理性质,最外层电子数小于3的原子,化学反应中易失去电子.
故答案为:失.
(3)根据质量守恒定律:在化学反应中,反应前后原子的种类没有改变,数目没有增减,可推断化学方程式为:Cu+2H2SO4(浓)
 CuSO4+2H2O+X↑ 中X的化学式为SO2.
CuSO4+2H2O+X↑ 中X的化学式为SO2.故答案为:SO2.
(4)所给五种金属分别放入到同一盐酸中,最剧烈的反应即是化学活动性最强的金属,在五种金属中镁的活动性最强,反应最剧烈.
故答案为:Mg+2HCl═MgCl2 +H2↑.
(5)加入的铁全部发生了反应,则一定有银被置换出来;由于铁粉为一定量,所以无法判断铁粉是否与AgNO3完全反应,也就无法进一步判断是否和混合溶液中的往Cu(NO3)2发生了反应;因此,只能得到滤液中一定含有Fe(NO3)2、滤渣中一定含有Ag的结论.
故选C.

练习册系列答案
相关题目