题目内容
有一小包质量为ag的NaHCO3和Ca(HCO3)2的固体混合物,小明将该包固体充分加热(仅发生反应:①Ca(HCO3)2
CaCO3+CO2↑+H2O ②2NaHCO3
Na2CO3+CO2↑+H2O ),将生成的CO2全部通入足量的石灰水中产生bg CaCO3沉淀;芳芳在小明加热、冷却后的试管中又加入足量的稀盐酸,再将生成的气体全部通入足量的石灰水,结果产生cg CaCO3沉淀.那么下列关系一定正确的是( )
| ||
| ||
| A、a=c | B、a<b+c |
| C、b<c | D、a<b |
分析:混合物中碳元素通过两条途径分别转化到碳酸钙沉淀中,其中一条途径是通过加热分解出的二氧化碳与氢氧化钙反应而转移到碳酸钙中,另一途径则是把分解后碳酸钙与碳酸钠中的碳转变为二氧化碳后再与氢氧化钙反应而转移到碳酸钙中;根据题意,两条途径所转移碳元素的质量相等,因此两个途径所得到的碳酸钙也相等;而固体混合物中碳元素的质量分数大于碳酸钙中碳元素质量分数,因此也得到最终所得碳酸钙的总质量大于原固体混合物的质量.
解答:解:
根据①Ca(HCO3)2
CaCO3+CO2↑+H2O,碳酸氢钙中碳元素平均转移到生成的碳酸钙和二氧化碳中; ②2NaHCO3
Na2CO3+CO2↑+H2O 碳酸氢钠中的碳元素也平均转移到碳酸钠和二氧化碳中;由此可判断受热分解后所得二氧化碳气体中碳元素质量与剩余固体中碳元素质量相等;所以加热分解所得气体二氧化碳的质量等于剩余固体与盐酸反应放出二氧化碳气体的质量,可判断b=c;
根据化学变化前后元素质量不变,小明和芳芳所得碳酸钙的总和(b+c)g中碳元素全部来自于固体混合物中所有碳元素,即(b+c)g碳酸钙中所含的碳元素质量等于ag的NaHCO3和Ca(HCO3)2的固体混合物中所含的碳元素的质量;而碳酸钙中碳元素的质量分数=
×100%=12%,碳酸氢钠中碳元素质量分数=
×100%≈14%,碳酸氢钙中碳元素的质量分数=
×100%≈15%,由此可知碳酸钙中碳元素的质量分数小于NaHCO3和Ca(HCO3)2的固体混合物中碳元素的质量分数,因此当两者碳元素质量相等时,两者的质量关系为:a<b+c;
由于b=c,而NaHCO3和Ca(HCO3)2的固体混合物中碳元素的质量分数在14%~15%之间,而碳酸钙中碳元素质量分数为12%,可得a>b=c,因此a=c、a<b的判断都不正确;
故选B.
根据①Ca(HCO3)2
| ||
| ||
根据化学变化前后元素质量不变,小明和芳芳所得碳酸钙的总和(b+c)g中碳元素全部来自于固体混合物中所有碳元素,即(b+c)g碳酸钙中所含的碳元素质量等于ag的NaHCO3和Ca(HCO3)2的固体混合物中所含的碳元素的质量;而碳酸钙中碳元素的质量分数=
| 12 |
| 100 |
| 12 |
| 84 |
| 24 |
| 162 |
由于b=c,而NaHCO3和Ca(HCO3)2的固体混合物中碳元素的质量分数在14%~15%之间,而碳酸钙中碳元素质量分数为12%,可得a>b=c,因此a=c、a<b的判断都不正确;
故选B.
点评:根据化学变化前后元素质量不变,解答本题时需要关注转化过程中碳元素质量不变这一特殊情况,抓住变化中碳元素的质量关系就抓住了问题的关键.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 CaCO3+CO2↑+H2O ②2NaHCO3
CaCO3+CO2↑+H2O ②2NaHCO3 Na2CO3+CO2↑+H2O ),将生成的CO2全部通入足量的石灰水中产生bg CaCO3沉淀;芳芳在小明加热、冷却后的试管中又加入足量的稀盐酸,再将生成的气体全部通入足量的石灰水,结果产生cg CaCO3沉淀.那么下列关系一定正确的是( )
Na2CO3+CO2↑+H2O ),将生成的CO2全部通入足量的石灰水中产生bg CaCO3沉淀;芳芳在小明加热、冷却后的试管中又加入足量的稀盐酸,再将生成的气体全部通入足量的石灰水,结果产生cg CaCO3沉淀.那么下列关系一定正确的是( )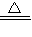 CaCO3+CO2↑+H2O ②2NaHCO3
CaCO3+CO2↑+H2O ②2NaHCO3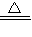 Na2CO3+CO2↑+H2O ),将生成的CO2全部通入足量的石灰水中产生bg CaCO3沉淀;芳芳在小明加热、冷却后的试管中又加入足量的稀盐酸,再将生成的气体全部通入足量的石灰水,结果产生cg CaCO3沉淀.那么下列关系一定正确的是( )
Na2CO3+CO2↑+H2O ),将生成的CO2全部通入足量的石灰水中产生bg CaCO3沉淀;芳芳在小明加热、冷却后的试管中又加入足量的稀盐酸,再将生成的气体全部通入足量的石灰水,结果产生cg CaCO3沉淀.那么下列关系一定正确的是( )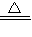 CaCO3+CO2↑+H2O ②2NaHCO3
CaCO3+CO2↑+H2O ②2NaHCO3 Na2CO3+CO2↑+H2O ),将生成的CO2全部通入足量的石灰水中产生bg CaCO3沉淀;芳芳在小明加热、冷却后的试管中又加入足量的稀盐酸,再将生成的气体全部通入足量的石灰水,结果产生cg CaCO3沉淀.那么下列关系一定正确的是( )
Na2CO3+CO2↑+H2O ),将生成的CO2全部通入足量的石灰水中产生bg CaCO3沉淀;芳芳在小明加热、冷却后的试管中又加入足量的稀盐酸,再将生成的气体全部通入足量的石灰水,结果产生cg CaCO3沉淀.那么下列关系一定正确的是( )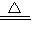 CaCO3+CO2↑+H2O ②2NaHCO3
CaCO3+CO2↑+H2O ②2NaHCO3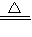 Na2CO3+CO2↑+H2O ),将生成的CO2全部通入足量的石灰水中产生bg CaCO3沉淀;芳芳在小明加热、冷却后的试管中又加入足量的稀盐酸,再将生成的气体全部通入足量的石灰水,结果产生cg CaCO3沉淀.那么下列关系一定正确的是( )
Na2CO3+CO2↑+H2O ),将生成的CO2全部通入足量的石灰水中产生bg CaCO3沉淀;芳芳在小明加热、冷却后的试管中又加入足量的稀盐酸,再将生成的气体全部通入足量的石灰水,结果产生cg CaCO3沉淀.那么下列关系一定正确的是( )