题目内容
100克稀盐酸恰好与80克10%的氢氧化钠溶液完全反应.求:(1)稀盐酸中溶质的质量分数是多少?
(2)反应后所得溶液中溶质质量分数是多少?
【答案】分析:根据稀盐酸与氢氧化钠反应生成氯化钠和水反应的化学方程式,由氢氧化钠的质量计算出盐酸中氯化氢及反应后所得溶液中溶质氯化钠的质量,利用溶液的溶质质量分数计算公式完成两溶液中溶质质量分数的计算.
解答:解:设稀盐酸中溶质质量为x,生成的氯化钠质量为y
反应消耗氢氧化钠的质量=80g×10%=8g
NaOH+HCl═NaCl+H2O
40 36.5 58.5
8g x y
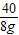 =
= x=7.3g 稀盐酸中溶质的质量分数=
x=7.3g 稀盐酸中溶质的质量分数=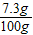 ×100%=7.3%
×100%=7.3%
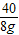 =
=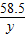 y=11.7g 反应后所得溶液中溶质质量分数=
y=11.7g 反应后所得溶液中溶质质量分数=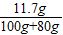 ×100%=6.5%
×100%=6.5%
答:(1)稀盐酸中溶质的质量分数是7.3%;(2)反应后所得溶液中溶质质量分数6.5%.
点评:根据化学方程式可以表示反应中各物质的质量比,由反应中某物质的质量可计算出其它物质的质量.
解答:解:设稀盐酸中溶质质量为x,生成的氯化钠质量为y
反应消耗氢氧化钠的质量=80g×10%=8g
NaOH+HCl═NaCl+H2O
40 36.5 58.5
8g x y
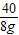 =
= x=7.3g 稀盐酸中溶质的质量分数=
x=7.3g 稀盐酸中溶质的质量分数=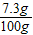 ×100%=7.3%
×100%=7.3%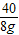 =
=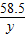 y=11.7g 反应后所得溶液中溶质质量分数=
y=11.7g 反应后所得溶液中溶质质量分数=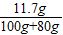 ×100%=6.5%
×100%=6.5%答:(1)稀盐酸中溶质的质量分数是7.3%;(2)反应后所得溶液中溶质质量分数6.5%.
点评:根据化学方程式可以表示反应中各物质的质量比,由反应中某物质的质量可计算出其它物质的质量.

练习册系列答案
相关题目