题目内容
【题目】用质量相等的锌粉和铁粉,分别与溶质质量分数相同且等质量的稀盐酸充分发生反应,产生氢气的质量与时间的关系如图所示。
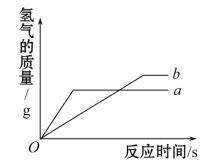
请回答下列问题:
(1)表示锌粉与稀盐酸反应的曲线为 (填a或b)。
(2)对于a曲线表示的反应,物质 (填名称)有剩余。
【答案】(1)a (2)稀盐酸
【解析】锌比铁活泼,与酸反应速度快,即在相同时间内产生氢气的质量大,所以曲线a为锌粉与稀盐酸反应的曲线,曲线b为铁粉与稀盐酸反应的曲线。由图看出,锌最终产生的氢气质量比铁产生的少,铁、锌与盐酸反应的化学方程式分别为:Fe+2HCl=FeCl2+H2↑,Zn+2HCl=ZnCl2+H2↑,由化学方程式中各物质间的质量比知,两个反应中酸不可能都完全反应(若酸完全反应,则生成的氢气质量相等), 又因为相同质量的铁和锌完全反应,铁消耗的酸和产生的氢气质量比锌多,在这种情况下,与锌反应的稀盐酸一定有剩余。

 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案【题目】小明选择“铝丝和盐酸反应的快慢与什么因素有关”的课题开展探究。下表是他分别用相同质量的铝丝和足量稀盐酸反应的三组实验数据:
实验编号 | 盐酸的浓度/% | 反应温度/℃ | 铝丝消失 的时间/s |
① | 3 | 20 | 500 |
② | 6 | 20 | 300 |
③ | 6 | 30 | 80 |
(1)写出铝和盐酸反应的化学方程式:________________________________。
(2)实验②和③表明:该反应的快慢与__________有关。
(3)能表明盐酸浓度对反应快慢有影响的实验编号是________和________。
(4)如果把实验①中盐酸的浓度改为4%,请你推出铝丝消失的时间(用t表示)的取值范围:________________。
(5)该实验除了用铝丝消失的时间来衡量反应的快慢外,你还能提出新的方法来衡量该反应的快慢吗?
方法:_____________________________________________________________________。