题目内容
(6分) 化学变化是化学研究的对象之一,也是人们认识物质组成、性质,实现物质转化,以及获取能源的重要手段。
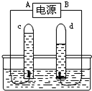
(1)通过研究下图所示的变化,可以确定水的组成。图中与试管a相连的是电源
的 (填“正”或“负”)极。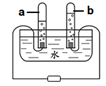
(2)化学变化是人类获取能量的重要方法。下列化学反应,没有明显热量变化的是 (填字母序号)。
A.镁条与稀盐酸 B.生石灰与水 C.氯化铵和氢氧化钡 D.氧化铁与稀硫酸
(3)在一定条件下,A与B能发生反应生成C和D,反应前后四种物质微观图如下: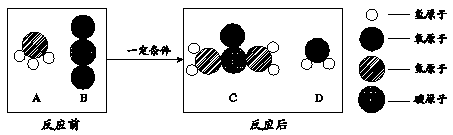
下列结论,能从该图示得出的是 (填字母序号)。
A.化学反应前后原子的种类不变 B. 化学反应前后原子的个数不变
C.化学反应前后元素的种类不变 D.化学反应前后分子的种类改变
(4)通过下图所示实验研究金属钠的性质。回答下列问题: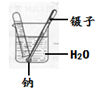
①向反应后的烧杯中滴加无色酚酞,无色酚酞变为红色,由此推测钠与水反应的产物有 。
②观察到钠与水反应生成气体,试推测该气体的成分并说明理由 。
(1)负;(2)D ;(3)ACD ;(4)①氢氧化钠(NaOH)
②氢气,根据质量守恒定律的元素守恒,生成物可能是氢气或氧气,但若生成氧气,不能使原子个数守恒。(只说质量守恒不能得满分)。
解析试题分析:(1)看图可知:电解时正极产生氧气,负极产生氢气,二者的体积比是1:2;(2)镁条和稀盐酸反应放热,生石灰和水反应放热,氯化铵和氢氧化钡反应放热,氧化铁和稀硫酸反应既不放热也不吸热;(3)反应前三种原子反应后还是那三种原子,所以元素种类不变,分子种类发生改变,但没有体现出原子个数不改变,故答案选ACD;(4)碱能使酚酞变红色和反应前后元素种类不变确定钠和水的产物,化学反应前后质量守恒定律的元素守恒,故答案:①氢氧化钠(NaOH);②氢气,根据质量守恒定律的元素守恒,生成物可能是氢气或氧气,但若生成氧气,不能使原子个数守恒.
考点:电解水实验;金属的化学性质;微粒观点及模型图的应用;物质发生化学变化时的能量变化

(6分)水是最普通、最常见的物质之一。
(1)“水”有很多种。下列“水”属于纯净物的是 (填字母序号)。
| A.河水 | B.自来水 | C.矿泉水 | D.蒸馏水 |
(3)水是重要的溶剂和化工原料。氯碱工业以饱和食盐水为原料获得烧碱等
化工产品,反应原理为:2NaCl + 2H2O通电2NaOH + H2↑ + Cl2↑ 。
①20℃时,NaCl 的溶解度是36 g。该温度下,饱和食盐水中溶质与溶剂的质量为 。
②烧碱可用于处理硫酸泄漏,反应的化学方程式为 。
(4)水在化学实验中具有重要作用。将铁丝放在潮湿的空气中(如图所示),一段时间后,观察到导管内液面下降,导管口有气泡冒出,关闭 K。请解释导管内液面上升和下降的原因: 。

(7分)水和溶液在生产、生活中起着十分重要的作用。
(1)下图是电解水实验装置。在实验过程中,试管1产生的气体是 ,写出水在通电条件下反应的化学方程式 。
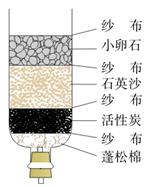
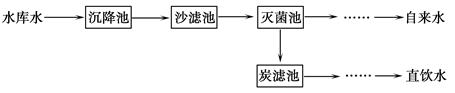
(2)将源水处理成自来水的过程中需加入生石灰,生石灰与水反应的化学方程式为__ __。
(3)20℃时,氯化钠的溶解度为36g,则20℃时氯化钠饱和溶液中溶质和溶剂的质量比为 。
(4)为了进行农业选种,现将200g30%的氯化钠溶液稀释为10%的氯化钠溶液,需要加水的质量为 。
(5)自来水中通入少量氯气可以杀菌消毒,化工厂常用浓氨水检测氯气储存设备或者输气管是否有氯气泄漏。A、B、C、D表示4种物质,其微观示意图见下表,A和B在一定条件下反应生成C和D。
| 物质 | A | B | C | D |  |
| 化学式 | NH3 | Cl2 | N2 | | |
| 微观示意图 |  |  | 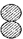 |  |
若17 g A参加反应,则生成C的质量为 g。
(10分)化学与生活密切相关。请用相关的化学知识回答下列问题:
(1)铁锅是有益于人类健康的理想炊具,主要原因是 ,但它很容易跟水和
等发生反应而生锈,写出一种预防铁锅生锈的具体做法 。
(2)临近中考,妈妈为了给小丽增加营养,制定了午餐食谱如下:米饭、炸鸡腿、清蒸鱼、牛奶。食谱中富含糖类的食物是 ,为了营养均衡,你建议小丽的妈妈还应增加的食物是 (写一种)。
(3)今年年初我国多地出现了雾霾天气,PM2.5是造成这种天气的“无凶”之一。
①PM2.5是指大气中直径小于或等于2.5微米的颗粒物,也称可入肺颗粒物。下列行为会产生PM2.5的是 。
| A.将校园的垃圾堆积起来,就地焚烧 | B.为方便出行,提倡大量购买和使用私家车 |
| C.大力发展火力发电 | D.节日里燃放鞭炮 |