题目内容
某同学在学习了二氧化碳的实验室制法后,对当地石灰石产生了兴趣.他取这种石灰石样品25g,加入188.8g一定适量分数的稀盐酸,充分反应后,共收集到8.8g气体(石灰石中的杂质既不溶于水,也不和稀盐酸反应).求:
(1)石灰石样品中碳酸钙的质量分数.
(2)反应反应后所得溶液中溶质的质量分数.
(1)石灰石样品中碳酸钙的质量分数.
(2)反应反应后所得溶液中溶质的质量分数.
分析:(1)将二氧化碳的质量代入化学反应方程式来计算碳酸钙的质量,再计算碳酸钙的质量分数;
(2)利用化学反应方程式计算出溶质氯化钙的质量,溶液的质量等于碳酸钙的质量加上稀盐酸的质量减去二氧化碳的质量,最后再利用溶液的质量来计算溶质的质量分数.
(2)利用化学反应方程式计算出溶质氯化钙的质量,溶液的质量等于碳酸钙的质量加上稀盐酸的质量减去二氧化碳的质量,最后再利用溶液的质量来计算溶质的质量分数.
解答:解:(1)设石灰石中碳酸钙的质量为x,生成的氯化钙的质量为y,则
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 111 44
x y 8.8g
=
解得x=20g
=
解得y=22.2g;
该样品中碳酸钙的质量分数为
×100%=80%;
答:石灰石样品中碳酸钙的质量分数80%;
(2)因杂质既不溶于水,也不与其他物质反应,则溶液的质量为20g+188.8g-8.8g=200g,溶质的质量为22.2g,
则溶质的质量分数为
×100%=11.1%.
答:反应后所得溶液中溶质的质量分数为11.1%.
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 111 44
x y 8.8g
| 100 |
| x |
| 44 |
| 8.8g |
解得x=20g
| 111 |
| y |
| 44 |
| 8.8g |
解得y=22.2g;
该样品中碳酸钙的质量分数为
| 20g |
| 25g |
答:石灰石样品中碳酸钙的质量分数80%;
(2)因杂质既不溶于水,也不与其他物质反应,则溶液的质量为20g+188.8g-8.8g=200g,溶质的质量为22.2g,
则溶质的质量分数为
| 22.2g |
| 200g |
答:反应后所得溶液中溶质的质量分数为11.1%.
点评:本题考查学生利用化学反应方程式的计算,明确二氧化碳是气体并利用质量守恒来计算二氧化碳的质量是解答的关键.

练习册系列答案
相关题目
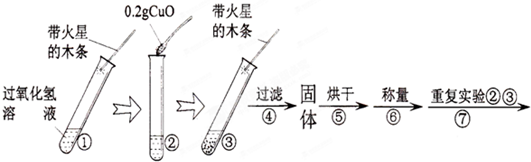
 某学校化学兴趣小组同学在学习了制取氧气这一节内容后,发现在实验室里用5%H2O2溶液加热制O2,用带火星的木条检验,木条很难复燃.同学们经过认真观察,猜想其可能原因是
某学校化学兴趣小组同学在学习了制取氧气这一节内容后,发现在实验室里用5%H2O2溶液加热制O2,用带火星的木条检验,木条很难复燃.同学们经过认真观察,猜想其可能原因是