题目内容
下图是“×××”补钙商品标签图.请根据标签信息完成下列两题:
(1)每片药剂中至少含钙元素的质量为______g.
(2)小明为测定其碳酸钙的含量标注是否属实,他取出4片片剂,研碎后放入烧杯中,逐滴加入稀盐酸,至不再放出气体为止,共用去稀盐酸40.0g,称量烧杯中剩余物质量为47.8g(不含烧杯质量,假定钙片其他成分不与盐酸反应.)通过计算判断钙片中碳酸钙的含量.
【答案】分析:(1)先计算出碳酸钙(CaCO3)中钙元素的质量分数,然后用每片所含碳酸钙的质量乘以钙元素的质量分数即可;
(2)根据物质质量守恒,计算出生成的二氧化碳的质量,再根据化学方程式,得出各物质之间的质量比,列出比例式,即可计算出4片钙片中碳酸钙的质量,进而计算出一片钙片中碳酸钙的质量,再与标签做比较即可.
解答:?解:(1)碳酸钙(CaCO3)中钙元素的质量分数为: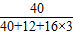 ×100%=40%,
×100%=40%,
1.24g×40%=0.496g,
故答案为:0.496g.
(2)生成二氧化碳的质量为:2.5g×4+40.0g-47.8g=2.2g,
设参与反应的CaCO3的质量为x
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
x 2.2g
∴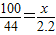
解之得:x=5g
每片碳酸钙的质量为:5g÷4=1.25g>1.24g,
答:钙片中碳酸钙的含量属实.
点评:本题主要考查学生运用化学方程式进行和质量分数公式进行计算的能力.
(2)根据物质质量守恒,计算出生成的二氧化碳的质量,再根据化学方程式,得出各物质之间的质量比,列出比例式,即可计算出4片钙片中碳酸钙的质量,进而计算出一片钙片中碳酸钙的质量,再与标签做比较即可.
解答:?解:(1)碳酸钙(CaCO3)中钙元素的质量分数为:
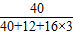 ×100%=40%,
×100%=40%,1.24g×40%=0.496g,
故答案为:0.496g.
(2)生成二氧化碳的质量为:2.5g×4+40.0g-47.8g=2.2g,
设参与反应的CaCO3的质量为x
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
x 2.2g
∴
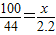
解之得:x=5g
每片碳酸钙的质量为:5g÷4=1.25g>1.24g,
答:钙片中碳酸钙的含量属实.
点评:本题主要考查学生运用化学方程式进行和质量分数公式进行计算的能力.

练习册系列答案
相关题目
?下图是“×××”补钙商品标签图.请根据标签信息完成下列两题:
(1)每片药剂中至少含钙元素的质量为______g.
(2)小明为测定其碳酸钙的含量标注是否属实,他取出4片片剂,研碎后放入烧杯中,逐滴加入稀盐酸,至不再放出气体为止,共用去稀盐酸40.0g,称量烧杯中剩余物质量为47.8g(不含烧杯质量,假定钙片其他成分不与盐酸反应.)通过计算判断钙片中碳酸钙的含量标注是否属实.
| ×××儿童咀嚼片 (60片装) [主要成分]碳酸钙、维生素D |
| [功效]补钙 [规格]25g/片 每片中含: 碳酸钙≥124g 维生素D100IU [食用方法]嚼食.每日1片 |
(2)小明为测定其碳酸钙的含量标注是否属实,他取出4片片剂,研碎后放入烧杯中,逐滴加入稀盐酸,至不再放出气体为止,共用去稀盐酸40.0g,称量烧杯中剩余物质量为47.8g(不含烧杯质量,假定钙片其他成分不与盐酸反应.)通过计算判断钙片中碳酸钙的含量标注是否属实.
下图是“×××钙片商品标签图”
根据标签内容信息,计算回答下列问题:
(1)主要成分碳酸钙中钙元素的质量分数为______,每片中至少含钙元素的质量为______g.
(2)小红同学为测定其碳酸钙的含量标注是否属实,她取出4片钙片,研碎后放入烧杯中,逐滴加入稀盐酸,至不再放出气体为止,共用去稀盐酸40.0g.称量烧杯中剩余物为47.8g(不含烧杯质量,假定钙片其他成分不与稀盐酸反应).试计算:①生成二氧化碳的质量;______
②通过计算判断钙片中碳酸钙的含量标注是否属实.(要求有计算过程)______.
| ×××儿童咀嚼片(60片装) |
| [主要成分]碳酸钙,维生素D [规格]2.5g/片,每片中含碳酸钙≥1.24g,维生素D 100l.U. [食用方法]嚼食,每天一片 [功效]补钙 |
(1)主要成分碳酸钙中钙元素的质量分数为______,每片中至少含钙元素的质量为______g.
(2)小红同学为测定其碳酸钙的含量标注是否属实,她取出4片钙片,研碎后放入烧杯中,逐滴加入稀盐酸,至不再放出气体为止,共用去稀盐酸40.0g.称量烧杯中剩余物为47.8g(不含烧杯质量,假定钙片其他成分不与稀盐酸反应).试计算:①生成二氧化碳的质量;______
②通过计算判断钙片中碳酸钙的含量标注是否属实.(要求有计算过程)______.
下图是“×××”钙片商品标签图.你能根据标签信息完成下列两题吗?.
(1)主要成分碳酸钙的相对分子质量为______;每片中至少含钙元素的质量为______g.(保留两位有效数字)
(2)小蓉同学为测定其碳酸钙的含量标注是否属实,她取出4片片剂,研碎后放入烧杯中,逐滴加入稀盐酸,至不再放出气体为止,共用去稀盐酸40.0g,称量烧杯中剩余物质的质量为47.8g(不含烧杯质量,假定钙片其他成分不与盐酸反应.)(反应的化学方程式为:CaCO3+2HCl=CaCl2+H2O+CO2↑)请求出:
①生成二氧化碳的质量;
②稀盐酸中溶质的质量分数(精确到0.01);
(3)通过计算判断钙片中碳酸钙的含量标注是否属实.
(1)主要成分碳酸钙的相对分子质量为______;每片中至少含钙元素的质量为______g.(保留两位有效数字)
(2)小蓉同学为测定其碳酸钙的含量标注是否属实,她取出4片片剂,研碎后放入烧杯中,逐滴加入稀盐酸,至不再放出气体为止,共用去稀盐酸40.0g,称量烧杯中剩余物质的质量为47.8g(不含烧杯质量,假定钙片其他成分不与盐酸反应.)(反应的化学方程式为:CaCO3+2HCl=CaCl2+H2O+CO2↑)请求出:
①生成二氧化碳的质量;
②稀盐酸中溶质的质量分数(精确到0.01);
(3)通过计算判断钙片中碳酸钙的含量标注是否属实.
| ×××儿童咀嚼片 (60片装) |
| [主要成分]碳酸钙,维生素D [规格]2.5g/片,每片中含碳酸钙≥1.24g,维生素D 100l.U. [食用方法]嚼食,每天一片 [功效]补钙 |

