题目内容
【题目】用如图所示装置来测定空气中氧气的含量(提示:铜在加热条件下能与空气中的氧气反应,不与其他成分反应)。对该实验认识错误的是( )
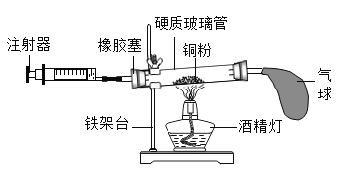
A. 铜粉应稍过量
B. 实验结束后冷却到室温才能读数
C. 气球的作用是调节气压,使氧气完全反应
D. 在正常操作情况下,反应结束后消耗氧气的总体积应该是反应前注射器内气体体积的五分之一
【答案】D
【解析】
A、要准确测定空气中氧气的体积分数,只有使用铜粉的量足够,才能全部消耗掉密闭注射器里的空气中的氧气,故A正确;B、气体的体积要受温度的影响,读数时必须等到装置冷却至室温再读,不等装置冷却至室温就读数,读数偏小,故B正确;C、气球的作用是调节气压,使氧气完全反应,故C正确;D、正常操作情况下,反应结束后消耗氧气的总体积应该是反应前注射器内气体体积和玻璃管中气体总体积的五分之一,故D错误。故选D。

【题目】某化学实验小组用如图所示方法验证空气中的氧气含量。
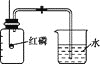
(1)写出图中红磷燃烧的文字表达式:__________________________;
(2)实验测定数据如下:(集气瓶的容积为100 mL)
组别 | 1 | 2 | 3 | 4 | 5 | 6 |
进入集气瓶中 水的体积/mL | 30 | 21 | 19 | 22 | 15 | 20 |
分析实验数据,第2、3、4、6组验证出氧气约占空气体积的________,第5组出现较大偏差的原因可能是________________。
【题目】目前全世界的镍(Ni)消费量仅次于铜、铝、铅、锌,居有色金属第五位。镍常用于各种高光泽装饰漆和塑料生产,也常用作催化剂。可以说镍行业发展蕴藏着巨大的潜力。
Ⅰ制备草酸镍
工业上可利用含镍合金废料(除镍外,还含有Fe、Cu、Ca、Mg、C等杂质)制取草酸镍(NiC2O4)。
根据下列工艺流程图回答问题:
(资料卡片1)
(1)过氧化氢(H2O2)俗称双氧水,是一种液体,受热易分解,可用于实验室制取氧气;过氧化氢具有强氧化性,所以常作为氧化剂、漂白剂和消毒剂。
(2)氧化反应可以从元素化合价升降的角度进行物质所含元素化合价升高的反应就是氧化反应。
(3)金属镍的化学性质类似于铁,与盐酸反应能生成氯化镍(NiCl2)。
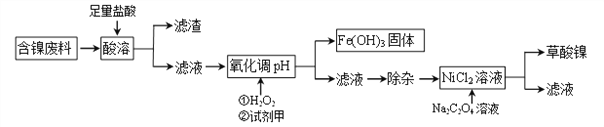
(1)“酸溶”之后的滤渣中含有的金属是_______________。
(2)写出酸溶过程中Ni与盐酸反应的化学方程式_________________________。
(3)加H2O2时,温度不能太高,其原因是_______________________。若H2O2在“酸溶”步骤即与盐酸同时加入,则与原方案相比滤液中会增加的金属离子是Cu2+和_______(写离子符号)。
(4)已知Na2C2O4溶液加入NiCl2溶液发生复分解反应,写出该反应的化学方程式____________。
Ⅱ制备镍粉
工业用电解镍液(主要含NiSO4)制备碱式碳酸镍晶体xNiCO3yNi(OH)2zH2O,并利用其制备镍粉,过程如下:
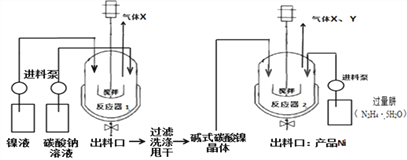
(5)反应器1中的一个重要反应为3NiSO4+3Na2CO3+2H2O ![]() NiCO32Ni(OH)2+3Na2SO4+2X,X的化学式为_________。
NiCO32Ni(OH)2+3Na2SO4+2X,X的化学式为_________。
(6)反应器1的出料口获得的固体洗涤时,需用纯水洗涤,可以用来检验固体已洗涤干净的试剂是____________。
(7)反应器2中产生的气体Y是空气中含量最多的气体,该气体是_________(填名称)。
Ⅲ 测定碱式碳酸镍晶体的组成
为测定碱式碳酸镍晶体(xNiCO3yNi(OH)2zH2O)组成,某小组设计了如下实验方案及装置:
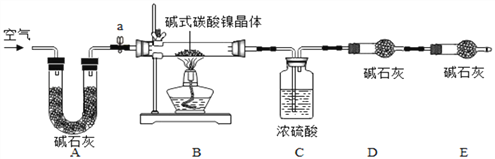
(资料卡片2)
(1)碱式碳酸镍晶体受热会完全分解生成NiO、CO2及H2O
(2)在温度控制不当导致温度过高时,NiO会被氧化成Ni2O3
(3)碱石灰是NaOH及CaO的混合物,可以吸收CO2和H2O
(实验步骤)
①检查装置气密性;②准确称取3.77g碱式碳酸镍晶体(xNiCO3yNi(OH)2zH2O)放在B装置中,连接仪器;③打开弹簧夹a,鼓入一段时间空气,分别称量装置C、D、E的质量;④关闭弹簧夹a,加热装置B至装置C中导管末端无气泡冒出;⑤打开弹簧夹a,缓缓鼓入一段时间空气;⑥分别准确称量装置C、D、E的质量;⑦根据数据进行计算(相关数据如下表)。
装置C/g | 装置D/g | 装置E/g | |
加热前 | 200.00 | 180.00 | 180.00 |
加热后 | 201.08 | 180.44 | 180.00 |
(实验分析及数据处理)
8)实验过程中步骤⑤鼓入空气的目的是__________________。
(9)计算3.77g碱式碳酸镍晶体(xNiCO3yNi(OH)2zH2O)中镍元素的质量_________(写出计算过程,计算结果准确到小数点后两位)。
(实验反思)
(10)另一小组同学在实验中发现,实验结束后,称得装置B中残留固体质量明显偏大,老师带领全组同学经过仔细分析后发现,这是由于该组同学加热时在酒精灯上加了铁丝网罩,温度过高所导致。请问该组同学称得的残留固体中镍元素的质量分数可能是__________。
A.70.08% B.75.88% C.78.67% D.79.58%
【题目】某校研究性学习小组的同学为了探究人呼出的气体与吸入的空气中氧气、二氧化碳和水蒸气的含量是否相同,设计了简单的实验方案,其主要操作步骤如图所示。请根据图示回答下列问题。
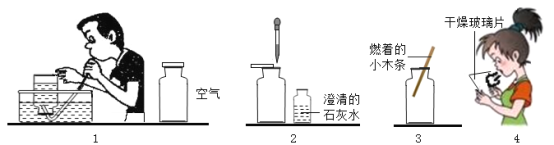
(1)图中收集呼出气体的方法是____________。
(2)下表是他们的探究方案,请你填写完整。
探究内容 | 实验方法 | 判断依据 |
二氧化碳含量是否相同 | ______ | ______ |
氧气含量是否相同 | ______ | ______ |
水蒸气含量是否相同 | ______ | ______ |
(3)结论:___________________。