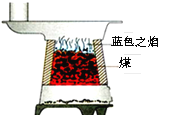
题目内容
【题目】某学校化学兴趣小组的同学,依据课本实验对化学反应前后质量变化进行了探究.
【查阅资料】①铁和硫酸铜反应生成硫酸亚铁和铜;②碳酸钠和稀盐酸反应生成氯化钠、水和二氧化碳。
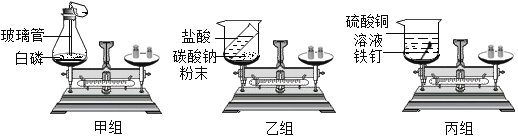
【实验装置设计】甲、乙、丙小组同学分别设计了如图装置:
(1)甲小组实验中,白磷燃烧时,可观察到的现象是_______________________,如果玻璃管上端没有系小气球,将可能出现的后果______________________________。
(2)请根据乙组和丙组设计的探究“质量守恒定律”的实验装置进行实验,并按照要求完成下表。(下表中的“实验结论分析”选择“=”“>”或“<”符号)
实验方案 | 乙组 | 丙组 |
反应现象 | __________________ | 铁钉表面覆盖一层红色物质,溶液由蓝色变成浅绿色 |
反应前的总质量 | m1 | n1 |
反应后的总质量 | m2 | n2 |
实验结论分析 | m1_____m2 | n1____n2 |
【实验分析】用乙小组的装置对质量守恒定律进行实验探究,反应前天平平衡,然后将稀盐酸倒入烧杯中与碳酸钠充分反应后,再称量,观察到反应后天平不平衡,天平指针向_____(填“左”或“右”)偏转,该反应__________(填“遵守”或“不遵守”)质量守恒定律。
【实验结论】参加反应的各物质的质量总和等于反应后生成的各物质的质量总和。
【反思与交流】通过对甲、乙、丙小组实验的探究,你得到的启示是_________________。
【答案】 放热,产生大量白烟 由于气体膨胀橡胶塞弹出 有大量气泡产生 > = 右 遵守 测定质量守恒的实验需要在密闭装置内进行
【解析】(1)白磷燃烧产生大量白烟,放出热量;白磷燃烧放出热量会导致锥形瓶内的压强变大,如果玻璃管上端没有系小气球,那么可能会导致胀橡胶塞弹出;(2)碳酸钠和稀盐酸反应生成氯化钠、水和二氧化碳气体,故观察到的现象是产生大量的气泡,由于生成的二氧化碳气体会逸散到空气中,故烧杯中的质量会减少,即天平指针向右边,该反应遵守质量守恒定律;铁和硫酸铜反应生成的是铜和硫酸亚铁,反应中没有气体参与也没有气体生成,故天平平衡;要验证质量守恒定律,若有气体参与或有气体生成的反应需要在密闭装置内进行。
【题型】科学探究题
【结束】
16
【题目】请根据下图回答问题:
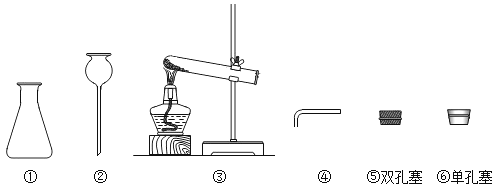
(1)写出下列仪器的名称: ②________________。
(2)如果用大理石和稀盐酸制取二氧化碳,则二氧化碳的制取装置应选图中的_________(填序号)等组装而成,其化学方程式为____________________________。
(3)装置③可用于制取__________(填化学式)气体,该气体可用________收集。
【答案】 长颈漏斗 ①⑤②④ ![]() O2(或其他符合题意的气体) 向上排空气法(或排水法)(与选择的气体对应)
O2(或其他符合题意的气体) 向上排空气法(或排水法)(与选择的气体对应)
【解析】(1)由图可知②是长颈漏斗;(2)根据反应物的状态和反应条件选择发生装置,用大理石和稀盐酸制取二氧化碳属于固液体常温下的反应,故需要锥形瓶、长颈漏斗、导气管和双孔橡皮塞,故选①⑤②④;大理石的主要成分是碳酸钙,碳酸钙和稀盐酸反应生成二氧化碳的同时还生成了氯化钙和水,反应的化学方程式表示为CaCO3+2HCl=CaCl2+H2O+CO2↑;(3)装置③属固固加热型,实验室可用于加热高锰酸钾或氯酸钾制取氧气,氧气的密度比空气大、难溶于水,可用向上排空气法或排水法收集。